
科目: 來源: 題型:
【化學—物質結構與性質】
下表中實線是元素周期表的部分邊界,其中上邊界并未用實線標出。

根據信息回答下列問題:
(1)周期表中比Ga質子數少2的基態原子價電子排布式為 。
(2)Fe元素位于周期表的 分區;Fe與CO易形成配合物Fe(CO)5,在Fe(CO)5中鐵的化合價為__________;已知:原子數目和電子總數(或價電子總數)相同的微粒互為等電子體,等電子體具有相似的結構特征。與CO分子互為等電子體的分子和離子分別為 ____和 _____(填化學式),CO的結構式為 。
(3)在CH4、CO及CH3OH中,碳原子采取sp3雜化的分子為 。
(4)根據VSEPR理論預測ED4- 離子的空間構型為______________型。B、C、D及E原子相互化合形成的分子中,所有原子都滿足最外層8電子穩定結構的電子式為:__________________________________(寫2種) 。
(5)B與D形成的穩定化合物為___________分子(填“極性”“非極性”),其固態為 ________晶體。
查看答案和解析>>
科目: 來源: 題型:
現有一包鋁熱劑是鋁粉和氧化鐵粉末的混合物,在高溫下使之充分反應,將反應后的固體分為兩等份,進行如下實驗(計算pH時假定溶液體積沒有變化):
①向其中一份固體中加入100mL 2.0mol·L-1的NaOH溶液,加熱使其充分反應后過濾,測得濾液的pH=14;
②向另一份固體中加入100mL 4.0 mol·L-1的HCl溶液,使固體全部溶解,測得反應后所得溶液中只有H+、Fe2+和Al3+三種陽離子且![]() pH=1。
pH=1。
則②產生氣體的體積(標準狀況)為( )
A.2.352L B.2.448L C.2.688L D.2.856L
查看答案和解析>>
科目: 來源: 題型:
設NA為阿伏加德羅常數的值,下列說法中正確的是
A.標準狀況下,22.4 L三氯甲烷中共價鍵數目為4NA
B.1mol Na2O2與足量的CO2和H2O(g)的混合物反應,轉移的電子數為NA
C.足量MnO2與含4 mol HCl的濃鹽酸反應生成的Cl2分子數為NA
D.1mol Cl2溶于水中轉移的電子數為NA
查看答案和解析>>
科目: 來源: 題型:
如圖所示,集氣瓶內充滿某混合氣體,置于光亮處,將滴管內的水擠入
 集氣瓶后,燒杯中的水會進入集氣瓶,該集氣瓶中的氣體可能是
集氣瓶后,燒杯中的水會進入集氣瓶,該集氣瓶中的氣體可能是
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
A.①② B.②③ C.②④ D.③④
查看答案和解析>>
科目: 來源: 題型:
以硫酸工藝的尾氣、氨水、石灰石、焦炭及碳酸氫銨和KCl為原料可以合成有重要應用價值的硫化鈣、硫酸鉀、亞硫酸氫銨等物質。合成路線如下:

(1)生產中,反應Ⅱ中往往需要向溶液中加入適量的對苯二酚等物質,其目的是 ▲ 。
(2)下列有關說法正確的是 ▲ 。
A.反應Ⅰ中需鼓入足量空氣,以保證二氧化硫充分氧化生成硫酸鈣
B.反應Ⅲ中發生反應的化學方程式為:CaSO4+4C![]() CaS +4CO↑
CaS +4CO↑
C.反應Ⅳ需控制在60~70℃,目的之一是減少碳酸氫銨的分解
D.反應Ⅴ中的副產物氯化銨可用作氮肥
(3)反應Ⅴ反應液用40%乙二醇溶液,溫度控制在25℃,硫酸鉀的產率超過90%,其原因是
▲ 。
(4)(NH4)2SO3可用于電廠等煙道氣中脫氮,將氮氧化物轉化為N2,試寫出二氧化氮與亞硫
酸銨反應的化學方程式 ▲ 。
查看答案和解析>>
科目: 來源: 題型:
X、Y、Z、W四種短周期元素的原子序數依次增大,它們之間可以相互形成等電子數的A2B2型、AB型、A2型、A22—型等微粒。
1)若A22—型微粒的電子數為14時:
① 寫出上述A2型微粒的結構式 _______________;
② 寫出四種元素原子按5∶1∶1∶3形成的離子化合物與足量NaOH反應的離子方程式 ;
(2)若A2型微粒為最活潑的非金屬單質時:
① 1mol A2B2型化合物分解轉移電子的物質的量為 ;
② 寫出一種具有相同電子數的![]() 有機物的化學式 ;
有機物的化學式 ;
③ 比較Z與W兩種元素的氫化物的沸點 。
查看答案和解析>>
科目: 來源: 題型:
化學在生產和日常生活中有著重要的應用。下列說法不正確的是
A.明礬凈水與膠體的性質有關
B.在海輪外殼上鑲入鋅塊,可減緩船體的腐蝕速度
C.金屬的冶煉:鋁可用電解法,鐵可用熱還原法
D.化纖材料、高溫結構陶瓷材料都屬于新型有機合成材料
查看答案和解析>>
科目: 來源: 題型:
T℃時,在2 L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖2所示:下列描述正確的是( )
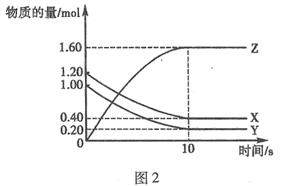
A.平衡時X、Y的轉化率相同
B.達到平衡后,將容器體積壓縮為1 L,平衡向正反應方向移動
C.T℃時,該反應的化學方程式為:X(g)+Y(g)![]() 2Z(g),平衡常數K=40
2Z(g),平衡常數K=40
D.T℃時,若起始時X為0.71mol,Y為1.00 mol,則平衡時Y的轉化率為60%
查看答案和解析>>
科目: 來源: 題型:
下列溶液中有關微粒的物質的量濃度關系正確的是( )
A.0.2mol/L NH4NO3和0.lmol/LNaOH溶液等體積混合后:c(NO3- )>c(Na+)>c(NH4+)>c(H+)>c(OH-)
B.常溫下將醋酸鈉、鹽酸兩溶液混合后,溶液呈中性,則混合后的溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C. 物質的量濃度相等的CH3COOH和CH3COONa溶液等體積混合后的溶液中:![]()
c(CH3COOH)+2 c (H+) = c(CH3COO—)+2c(OH-)
D.相同條件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀鹽酸溶液中由水電離出的c(H+):①>②>③
查看答案和解析>>
科目: 來源: 題型:
鎳-鎘可充電電池,電極材料是Cd和NiO(OH),電解質是KOH,放電時的電極反應式是 Cd+2OH-—2e-===Cd(OH)2,
2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-
 下列說法不正確的是
下列說法不正確的是
A.電池的總反應式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
B.電池充電時,鎘元素被還原
C.電池放電時,電池負極周圍溶液的pH不斷增大
D.電池充電時,電池的負極和電源的負極連接
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com