
科目: 來源: 題型:
【題目】已知![]() 氨基酸在一定條件下能與亞硝酸
氨基酸在一定條件下能與亞硝酸![]() 反應得到
反應得到![]() 羥基酸,如下:
羥基酸,如下:
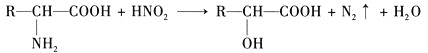
試根據如圖所示關系回答下列有關問題。
(1)寫出A、B的結構簡式:A_________;B_________。
(2)![]() 的化學方程式為________。
的化學方程式為________。
(3)![]() 的化學方程式為________。
的化學方程式為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】過碳酸鈉( Na2CO4)是一種很好的供氧劑,其與稀鹽酸反應的化學方程式為:2Na2CO4+4HCl=4NaCl+2CO2 +O2+2H2O.市售過碳酸鈉一般都含有碳酸鈉,為測定某過碳酸鈉樣品(只含Na2CO4和Na2CO3)的純度,某化學興趣小組采用以下兩種方案實施:
方案一:![]()
(1)操作①和③的名稱分別為
(2)上述操作中,使用到玻璃棒的有 __(填操作序號)。
(3)請簡述操作③的操作過程
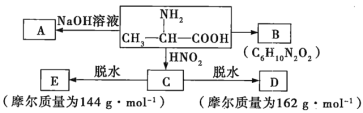
方案二:按下圖安裝好實驗裝置,Q為一塑料氣袋,隨意取適量樣品于其中,打開分液漏斗活塞,將稀鹽酸滴入氣袋中至充分反應。
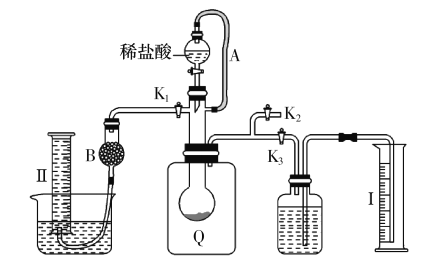
(4)為測定反應生成氣體的總體積,滴稀鹽酸前必須關閉 ,打開 (填“K1”、“K2”或“K3”)。導管a的作用是 。
(5)當上述反應停止后,使K1、K3處于關閉狀態,K2處于打開狀態,再緩緩打開Kl。 B中裝的固體試劑是 ,為何要緩緩打開K1? 。
(6)實驗結束時,量筒I中有xmL水,量筒Ⅱ中收集到了ymL氣體,則樣品中過碳酸鈉的質量分數是 。
查看答案和解析>>
科目: 來源: 題型:
【題目】我國產銅主要取自黃銅礦(CuFeS2),隨著礦石品位的降低和環保要求的提高,濕法煉銅的優勢日益突出。該工藝的核心是黃銅礦的浸出,目前主要有氧化浸出、配位浸出和生物浸出三種方法。
Ⅰ.氧化浸出
(1)在硫酸介質中用雙氧水將黃銅礦氧化,測得有![]() 生成。
生成。
①該反應的離子方程式為____________________________________________。
②該反應在25~50℃下進行,實際生產中雙氧水的消耗量要遠遠高于理論值,試分析其原因:_____________________________________________________。
Ⅱ.配位浸出
反應原理為:![]() (未配平)
(未配平)
(2)為提高黃銅礦的浸出率,可采取的措施有____________________(至少寫出兩點)。
(3)為穩定浸出液的pH,生產中需要向氨水中添加NH4Cl,構成NH3·H2O-NH4Cl緩沖溶液。某小組在實驗室對該緩沖體系進行了研究:25℃時,向a mol·L-1的氨水中緩慢加入等體積0.02mol·L-1的NH4Cl溶液,平衡時溶液呈中性。則NH3·H2O的電離常數Kb=________(用含a的代數式表示);滴加NH4Cl溶液的過程中水的電離平衡________(填“正向”“逆向”或“不”)移動。
Ⅲ.生物浸出
在反應釜中加入黃銅礦、硫酸鐵、硫酸和微生物,并鼓入空氣,黃銅礦逐漸溶解,反應釜中各物質的轉化關系如圖所示。
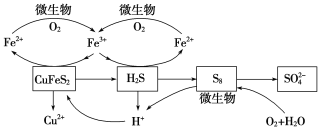
(4)在微生物的作用下,可以循環使用的物質有________(填化學式),微生物參與反應的離子方程式為______________________(任寫一個)。
(5)假如黃銅礦中的鐵元素最終全部轉化為Fe3+,當有2mol ![]() 生成時,理論上消耗O2的物質的量為________。
生成時,理論上消耗O2的物質的量為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】偽麻黃堿(D)是新康泰克的成分之一,能夠緩解感冒時帶來的鼻塞、流鼻涕和打噴嚏等癥狀,其中一種合成路線如下:
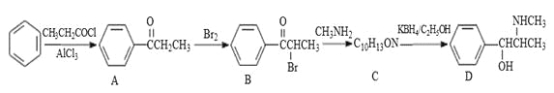
回答下列問題:
(1)偽麻黃堿(D)的分子式為 ;B中含有的官能團有 (寫名稱)。
(2)寫出 B—C反應的化學方程式: 。C—D的反應類型為 。
(3)B的消去產物可以用于合成高分子化合物E,請寫出 E的結構簡式: 。
(4)滿足下列要求的A的同分異構體有 種;
①能發生銀鏡反應
②苯環上的一氯代物有兩種結構,其中核磁共振氫譜為4組峰,且峰面積之比為6:2:1:1的為 (寫結構簡式)。
(5)已知:![]() 。參照上述合成路線,設計一條由苯和乙酸為起始原料制備
。參照上述合成路線,設計一條由苯和乙酸為起始原料制備![]() 的合成路線: 。
的合成路線: 。
查看答案和解析>>
科目: 來源: 題型:
【題目】葡萄糖發酵可制得乳酸,從酸牛奶中也能提取出乳酸,純凈的乳酸為無色黏稠液體,易溶于水。為了研究乳酸的分子組成和結構,進行如下實驗:
(1)稱取乳酸![]() ,在某種狀況下使其完全汽化,若相同狀況下等體積氫氣的質量為
,在某種狀況下使其完全汽化,若相同狀況下等體積氫氣的質量為![]() ,則乳酸的相對分子質量為_______。
,則乳酸的相對分子質量為_______。
(2)若將上述乳酸蒸氣在![]() 中燃燒只生成
中燃燒只生成![]() 和
和![]() ,當氣體全部被堿石灰吸收后,堿石灰的質量增加
,當氣體全部被堿石灰吸收后,堿石灰的質量增加![]() ;若將此氣體通過足量的石灰水,產生
;若將此氣體通過足量的石灰水,產生![]() 白色沉淀。則乳酸的分子式為________。
白色沉淀。則乳酸的分子式為________。
(3)乳酸分子能發生自身酯化反應,且其催化氧化產物不能發生銀鏡反應。若葡萄糖發酵只生成乳酸,試寫出該反應的化學方程式:_______(忽略反應條件)。
(4)寫出乳酸在催化劑作用下發生反應生成分子式為![]() 的環狀酯的結構簡式:__。
的環狀酯的結構簡式:__。
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)油酸的化學式為![]() ,其結構中含有
,其結構中含有![]() 、和
、和![]() 兩種官能團,則通過實驗檢驗
兩種官能團,則通過實驗檢驗![]() 的方法是__________;通過實驗檢驗
的方法是__________;通過實驗檢驗![]() 的方法是______。
的方法是______。
(2)![]() 某種油脂發生氫化反應,需標準狀況下氫氣的體積為
某種油脂發生氫化反應,需標準狀況下氫氣的體積為![]() ;等物質的量的該油脂氫化后,再發生皂化反應共消耗
;等物質的量的該油脂氫化后,再發生皂化反應共消耗![]() 。若該油脂是簡單甘油酯,則它的結構可表示為______。
。若該油脂是簡單甘油酯,則它的結構可表示為______。
查看答案和解析>>
科目: 來源: 題型:
【題目】有機物X、Y、M(已知M為乙酸)的轉化關系為:淀粉→X→Y![]() 乙酸乙酯,下列說法錯誤的是
乙酸乙酯,下列說法錯誤的是
A.X可用新制的氫氧化銅懸濁液檢驗
B.實驗室由Y和M制取乙酸乙酯時可用飽和NaOH溶液來提純
C.由Y生成乙酸乙酯的反應屬于取代反應
D.可用碘水檢驗淀粉是否水解完全
查看答案和解析>>
科目: 來源: 題型:
【題目】M是第四周期元素,最外層只有1個電子,次外層的所有原子軌道均充滿電子。元素Y的負一價離子的最外層電子數與次外層的相同。回答下列問題:
(1)單質M的晶體類型為______,晶體中原子間通過_____作用形成面心立方密堆積,其中M原子的配位數為______。
(2)元素Y基態原子的核外電子排布式為________,其同周期元素中,第一電離能最大的是______(寫元素符號)。元素Y的含氧酸中,酸性最強的是________(寫化學式),該酸根離子的立體構型為________。
(3)M與Y形成的一種化合物的立方晶胞如圖所示。

①該化合物的化學式為_______,已知晶胞參數a=0.542 nm,此晶體的密度為_______g·cm–3。(寫出計算式,不要求計算結果。阿伏加德羅常數為NA)
②該化合物難溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空氣則被氧化為深藍色,深藍色溶液中陽離子的化學式為_______。
查看答案和解析>>
科目: 來源: 題型:
【題目】硼及其化合物在耐高溫合金工業、催化劑制造、高能燃料等方面有廣泛應用。
(1)硼原子的價電子排布圖為____________。
(2)B2H6是一種高能燃料,它與Cl2反應生成的BCl3可用于半導體摻雜工藝及高純硅制造。由第二周期元素組成的與BCl3互為等電子體的陰離子為________。
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均為廣受關注的新型儲氫材料。
①B與N的第一電離能:B__________N(填“>”“<”或“=”,下同)。H2N―→BH2中B原子的雜化類型為________。
②Ti(BH4)3由TiCl3和LiBH4反應制得。BH4-的立體構型是________;寫出制備反應的化學方程式:____________。
(4)磷化硼(BP)是受到高度關注的耐磨材料,它可用作金屬表面的保護層。如圖為磷化硼晶胞。
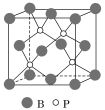
①磷化硼晶體屬于______________晶體(填晶體類型),____________(填“是”或“否”)含有配位鍵。
②晶體中P原子的配位數為____________。
③已知BP的晶胞邊長為a nm,NA為阿伏加德羅常數的數值,則磷化硼晶體的密度為____________g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目: 來源: 題型:
【題目】砷化鎵(GaAs)是優良的半導體材料,可用于制作微型激光器或太陽能電池的材料等。回答下列問題:
(1)寫出基態As原子的核外電子排布式___________。
(2)AsCl3分子的立體構型為_________,其中As的雜化軌道類型為________。
(3)GaF3的熔點高于1000℃,GaCl2的熔點為77.9℃,其原因是______________。
(4)GaAs的熔點為1238℃,密度為ρ g/cm3,其晶胞結構如圖所示。該晶體的類型為______________,Ga與As以______________鍵結合。Ga和As的摩爾質量分別為MGa g/mol和MAs g/mol,原子半徑分別為rGa pm和rAs pm,阿伏加德羅常數值為NA,則GaAs晶胞中原子的體積占晶胞體積的百分率為______________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com