
科目: 來源: 題型:
【題目】已知溶解度也可用物質的量濃度表示,25℃時,Ag2CrO4在不同濃度CrO42-溶液中的溶解度如圖所示,下列說法正確的是

A.圖中a、b兩點c(Ag+)相同
B.圖中a點與b點Ag2CrO4溶度積相等
C.在a點向溶液中加入少量AgNO3,溶解度可變為c點
D.該溫度下,Ag2CrO4溶度積的數量級為10-12
查看答案和解析>>
科目: 來源: 題型:
【題目】將濃度均為0.5mol·L-1的氨水和KOH溶液分別滴入到兩份均為20mLc1mol·L-1的AlCl3溶液中,測得溶液的導電率與加入堿的體積關系如圖所示。下列說法正確的是
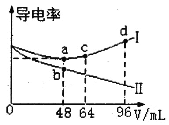
A.c1=0.2
B.b點時溶液的離子濃度:c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.ac段發生的反應為:A1(OH)3+OH-==[Al(OH)4]-
D.d點時溶液中:c(K+)+c(H+)==[Al(OH)4]-+c(OH-)
查看答案和解析>>
科目: 來源: 題型:
【題目】25℃時,向20mL0.1mol·L-1四氯金酸( HAuCl4)溶液中滴加0.1mol·L-1NaOH溶液,滴定曲線如圖1,含氯微粒的物質的量分數(δ)隨pH變化關系如圖2,則下列說法不正確的是
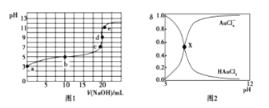
A. b點溶液中存在關系:2c(H+)+ c(HAuCl4)=2c(OH-)+ c(AuCl4-)
B. X點描述的是滴定曲線中b點含氯微粒的物質的量分數δ與pH的關系
C. c點溶液中存在關系:c(Na+)=c(AuCl4-)
D. d點時,溶液中微粒濃度的大小關系為c(Na+)>c(AuCl4-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 來源: 題型:
【題目】利用酸解法制鈦白粉產生的廢液[含有大量![]() 和少量
和少量![]() 、
、![]() ],生產鐵紅和補血劑乳酸亞鐵。其生產步驟如下:
],生產鐵紅和補血劑乳酸亞鐵。其生產步驟如下:
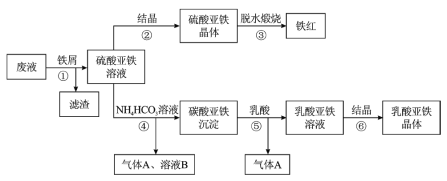
已知:![]() 可溶于水,在水中可以電離為
可溶于水,在水中可以電離為![]() 和
和![]() 水解成
水解成![]() 沉淀為可逆反應;乳酸亞鐵晶體的化學式為:
沉淀為可逆反應;乳酸亞鐵晶體的化學式為:![]() 。請回答:
。請回答:
(1)步驟①加入鐵屑的目的一是還原少量![]() ;二是使少量
;二是使少量![]() 轉化為
轉化為![]() 濾渣,用平衡移動的原理解釋得到濾渣的原因________。
濾渣,用平衡移動的原理解釋得到濾渣的原因________。
(2)硫酸亞鐵在空氣中煅燒生成鐵紅和三氧化硫,該反應中氧化劑和還原劑的物質的量之比為________。
(3)步驟④的離子方程式是______。
(4)步驟⑥所得溶液需隔絕空氣______、________過濾、洗滌、干燥得乳酸亞鐵晶體。該晶體存放時應____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】2019年諾貝爾化學獎頒給了三位為鋰離子電池發展作出重要貢獻的科學家。磷酸鐵鋰鋰離子電池充電時陽極反應式為,![]() ,放電工作示意圖如圖。下列敘述不正確的是
,放電工作示意圖如圖。下列敘述不正確的是
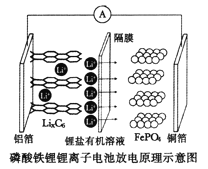
A.放電時,Li+通過隔膜移向正極
B.放電時,電子由鋁箔沿導線流向銅箔
C.放電時正極反應為:![]()
D.磷酸鐵鋰鋰離子電池充放電過程通過Li+遷移實現,C、Fe、P元素化合價均不發生變化
查看答案和解析>>
科目: 來源: 題型:
【題目】明礬[KA1(SO4)2·12H2O]是一種復鹽,在造紙等方面應用廣泛。采用廢易拉罐制備明礬的過程如下圖所示。
下列敘述錯誤的是
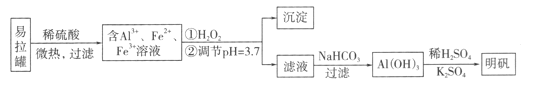
A. 合理處理易拉罐有利于環境保護和資源再利用
B. 從易拉罐中可回收的金屬元素有Al、Fe
C. “沉淀”反應的金屬離子為Fe3+
D. 上述流程中可用NaHSO4代替NaHCO3
查看答案和解析>>
科目: 來源: 題型:
【題目】T1溫度時在容積為2L的恒容密閉容器中只充入1.00molNO2氣體發生反應:2NO(g)+O2(g)![]() 2NO2(g) H<0。實驗測得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆為速率常數只受溫度影響。不同時刻測得容器中n(NO2)如下表:
2NO2(g) H<0。實驗測得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆為速率常數只受溫度影響。不同時刻測得容器中n(NO2)如下表:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
(1)從0~2s該反應的平均速率v(NO2)=__。
(2)T1溫度時化學平衡常數K=__L·mol-1。
(3)化學平衡常數K與速率常數k正、k逆的數學關系是K=__。若將容器的溫度改變為T2時其k正=k逆,則T2__T1(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】根據下列表格,回答有關問題:

(1)上表中,第一電離能最小的元素是__(填元素名稱,下同),電負性最大的元素是__。
(2)某元素最高價氧化物對應的水化物呈兩性,寫出該元素與c元素形成的化合物與NaOH溶液反應的離子方程式__。
(3)在e~k元素的原子中,原子半徑最小的是___(填元素符號),其價電子排布式為__;未成對電子數最多的是__(填元素符號),其最高價氧化物對應水化物的化學式為__;有兩個未成對電子的元素是__(填元素符號);M層有兩個空軌道的是__(填元素符號)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com