
科目: 來源: 題型:
【題目】可逆反應2A(g)+3B(g)![]() 4C(g)+D(g), 已知起始濃度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D濃度均等于0,反應開始2 秒后達到平衡狀態,此時D 的平衡濃度為0.5 mol·L-1,則下列說法不正確的是( )
4C(g)+D(g), 已知起始濃度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D濃度均等于0,反應開始2 秒后達到平衡狀態,此時D 的平衡濃度為0.5 mol·L-1,則下列說法不正確的是( )
A. 反應速率v(C)= 1mol/(L·s) B. C的平衡濃度為4mol /L
C. A的轉化率為25% D. B的平衡濃度為1.5mol /L
查看答案和解析>>
科目: 來源: 題型:
【題目】已知某可逆反應mA(g)+nB(g) ![]() pC(g)在密閉容器中進行,如圖表示在不同反應時間t時,溫度T和壓強p與反應物B在混合氣體中的體積分數B%的關系曲線,由曲線分析,下列判斷正確的是
pC(g)在密閉容器中進行,如圖表示在不同反應時間t時,溫度T和壓強p與反應物B在混合氣體中的體積分數B%的關系曲線,由曲線分析,下列判斷正確的是

A.T1<T2 p1<p2 m+n>p放熱反應
B.T1>T2 p1<p2 m+n<p吸熱反應
C.T1<T2 p1>p2 m+n>p放熱反應
D.T1>T2 p1<p2 m+n>p吸熱反應
查看答案和解析>>
科目: 來源: 題型:
【題目】在一定溫度下,可逆反應A(g)+2B(g)![]() 2C(g)達到平衡的標志是( )
2C(g)達到平衡的標志是( )
A.C的生成速率與C分解的速率相等
B.單位時間內生成nmol A,同時生成2nmol B
C.單位時間內消耗nmol A,同時生成2nmol C
D.B的生成速率與C分解的速率相等
查看答案和解析>>
科目: 來源: 題型:
【題目】汽車的啟動電源常用鉛蓄電池,電池反應如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根據此反應判斷下列敘述中正確的是( )
2PbSO4+ 2H2O,根據此反應判斷下列敘述中正確的是( )
A. PbO2放電時是電池的負極,充電時是電池的陽極
B. 負極的電極反應式為:Pb + SO42—– 2e–=PbSO4
C. 放電時,PbO2得電子,被氧化
D. 電池放電時,溶液酸性增強
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖所示的電解池I和II中,a、b、c和d均為Pt電極。電解過程中,電極b和d上沒有氣體逸出,但質量均增大,且增重b<d。符合上述實驗結果的鹽溶液是
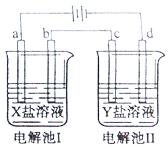
選項 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | NaCl |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 來源: 題型:
【題目】苯乙烯(![]() )是生產各種塑料的重要單體,可通過乙苯催化脫氫制得:
)是生產各種塑料的重要單體,可通過乙苯催化脫氫制得:
![]() (g)
(g)![]()
![]() (g)+H2(g) △H
(g)+H2(g) △H
(1)已知:
化學鍵 | C-H | C-C | C=C | H-H |
鍵能/kJ/mol | 412 | 348 | 612 | 436 |
計算上述反應的△H=________ kJ·mol-1。
(2)500℃時,在恒容密閉容器中,充入a mol乙苯,反應達到平衡后容器內氣體的壓強為P;若再充入bmol的乙苯,重新達到平衡后容器內氣體的壓強為2P,則a_______b(填“>” “<”或“=”),乙苯的轉化率將________(填“增大” “減小”或“不變”)。
(3)工業上,通常在乙苯(EB)蒸氣中摻混N2(原料氣中乙苯和N2的物質的量之比為1︰10,N2不參與反應),控制反應溫度600℃,并保持體系總壓為0.1Mpa不變的條件下進行反應。在不同反應溫度下,乙苯的平衡轉化率和某催化劑作用下苯乙烯的選擇性(指除了H2以外的產物中苯乙烯的物質的量分數)示意圖如下:
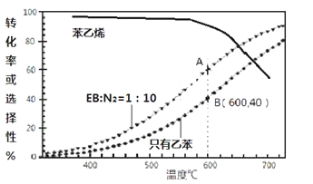
①A,B兩點對應的正反應速率較大的是________。
②摻入N2能提高乙苯的平衡轉化率,解釋說明該事實___________________________。
③用平衡分壓代替平衡濃度計算600℃時的平衡常數Kp=________。(保留兩位有效數字,分壓=總壓×物質的量分數)
④控制反應溫度為600℃的理由是___________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】科學家合成一種新化合物(如圖所示)。

其中W、X、Y、Z為同周期元素,W是所在周期中第一電離能最小的元素,Y元素基態原子的未成對電子數等于其電子層數,Z元素的原子核外最外層電子數是X核外電子數的一半。
回答下列問題:
(1)W、X、Y、Z原子半徑由大到小的順序為__(用對應的元素符號表示)。
(2)Z的核外電子排布式為__。
(3)基態X原子價電子軌道表示式為__。
(4)W元素基態原子核外電子有__種運動狀態,其中電子占據能量最高的原子軌道符號表示為__。
(5)X的電負性__(填“大于”或“小于”)Y,原因是__。
查看答案和解析>>
科目: 來源: 題型:
【題目】某種鋰離子電池的正極材料是將含有鈷酸鋰(LiCoO2)的正極粉均勻涂覆在鋁箔上制成的,可以再生利用.某校研究小組嘗試回收廢舊正極材料中的鈷。
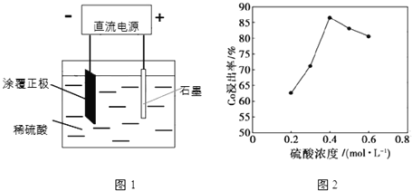
(1)25℃時,用圖1所示裝置進行電解,有一定量的鈷以Co2+的形式從正極粉中浸出,且兩極均有氣泡產生,一段時間后正極粉與鋁箔剝離。
①陰極的電極反應式為:LiCoO2+4H++e-=Li++Co2++2H2O,陽極的電極反應式為______。
②該研究小組發現硫酸濃度對鈷的浸出率有較大影響,一定條件下,測得其變化曲線如圖2所示。當c(H2SO4)>0.4molL-1時,鈷的浸出率下降,其原因可能為______。
(2)電解完成后得到含Co2+的浸出液,且有少量正極粉沉積在電解槽底部。用以下步驟繼續回收鈷。

①寫出“酸浸”過程中正極粉發生反應的化學方程式______。該步驟一般在80℃以下進行,溫度不能太高的原因是______。
②已知(NH4)2C2O4溶液呈弱酸性,下列關系中正確的是______(填字母序號)。
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]
查看答案和解析>>
科目: 來源: 題型:
【題目】焦亞硫酸鈉(Na2S2O5)在食品加工、印染、印刷、制革以及有機合成等工業中應用廣泛。實驗室模擬工業濕法制備焦亞硫酸鈉裝置如圖所示。
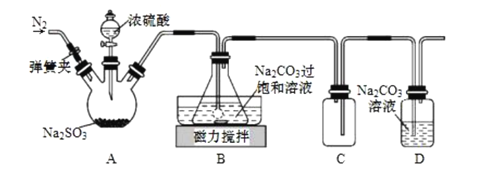
打開彈簧夾,通入一段時間N2后關閉彈簧夾,加入一定量濃硫酸;不斷攪拌,控制反應溫度在40℃左右,當溶液pH約為4.1時,停止反應,降溫至20℃左右靜置結晶。
已知:
①溫度在40℃左右時,發生反應2NaHSO3=Na2S2O5+H2O。
②溫度過高時焦亞硫酸鈉分解:Na2S2O5=Na2SO3+SO2↑。
③焦亞硫酸鈉與水易發生反應:Na2S2O5+H2O=2NaHSO3。
回答下列問題:
(1)A裝置中所加硫酸通常為1:1(體積比)的濃硫酸,一般不采用90%以上的濃硫酸,原因是__。
(2)B裝置中控制反應溫度40℃在左右的方法是__;錐形瓶中生成NaHSO3的離子方程式為__。
(3)裝置C的作用是__。
(4)錐形瓶中析出固體經減壓抽濾、洗滌、晾干,可獲產品。洗滌操作中依次用飽和SO2水溶液、無水乙醇洗滌,其作用是__。
(5)反應結束后,需要再次打開彈簧夾,通入一段時間N2,目的是__。
(6)某同學認為Na2S2O5屬于強堿弱酸鹽,在溶液中水解顯堿性。實際他測得Na2S2O5溶液顯酸性,請用數據幫他分析溶液顯酸性的原因__。
(已知:常溫下H2SO3電離常數Ka1=1.54×10-2,Ka2=1.02×10-7)
查看答案和解析>>
科目: 來源: 題型:
【題目】As2O3在醫藥、電子等領域有重要應用。某含砷元素(As)的工業廢水經如圖1流程轉化為粗產品。
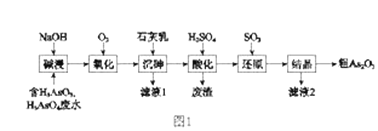
(1)“堿浸”的目的是將廢水中的H3AsO3和H3AsO4轉化為鹽。H3AsO4轉化為Na3AsO4反應的化學方程式是_______________________________。
(2)“氧化”時,1molAsO33-轉化為AsO43-至少需要O2______ mol。
(3)“沉砷”是將砷元素轉化為Ca5(AsO4)3OH沉淀,發生的主要反應有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳溫度是85℃。 用化學平衡原理解釋溫度高于85℃后,隨溫度升高沉淀率下降的原因是_____________________。
(4)“還原”過程中H3AsO4轉化為H3AsO3,反應的化學方程式是_______________________。
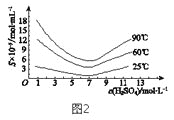
(5)“還原”后加熱溶液,H3AsO3分解為As2O3,同時結晶得到粗As2O3。As2O3在不同溫度和不同濃度硫酸中的溶解度(S)曲線如圖2所示。為了提高粗As2O3的沉淀率,“結晶”過程進行的操作是_______。
(6)下列說法中,正確的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工業生產中,濾液2可循環使用,提高砷的回收率
c.通過先“沉砷”后“酸化”的順序,可以達到富集砷元素的目的
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com