
科目: 來源: 題型:
【題目】氮及其化合物的轉化過程如圖所示。下列分析不合理的是
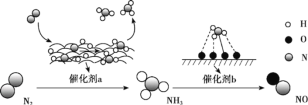
A.催化劑 a 表面發生了非極性共價鍵的斷裂和極性共價鍵的形成
B.催化劑不能改變反應焓變但可降低反應活化能
C.在催化劑 b 表面形成氮氧鍵時,涉及電子轉移
D.催化劑 a、b 能提高反應的平衡轉化率
查看答案和解析>>
科目: 來源: 題型:
【題目】研究課上,老師讓同學們各自選題進行計算,其結果正確的是
A.甲同學:0.2 mol MgO,經計算,其質量為0.2 g
B.乙同學:9.03×1023個O2,經計算,O2物質的量為1.5 mol
C.丙同學:標準狀況下,5.6 L 水的體積,經計算為 0.25 mol
D.丁同學:將30 mL0.5mol·L-1NaOH溶液加水稀釋到500mL,經計算,稀釋后溶液中NaOH的物質的量濃度為0.04mol·L-1
查看答案和解析>>
科目: 來源: 題型:
【題目】下列有關說法正確的是
A. 1L水中溶解了40.0 g NaOH,該溶液的物質的量濃度為1 mol/L
B. 從1L2mol/L的NaCl液中取出0.5L,取出的該溶液的濃度為1mol/L
C. 中和100 mL 1mol/L的H2SO4溶液,需NaOH8.0g
D. 配制500mL0.5mol/L的CuSO4溶液,需40.0g膽礬
查看答案和解析>>
科目: 來源: 題型:
【題目】利用電解質溶液的濃度對電極電勢的影響,可設計濃差電池。下圖為一套濃差電池和電解質溶液再生的配套裝置示意圖,閉合開關K之前,兩個Cu電極的質量相等。下列有關這套裝置的說法中錯誤的是

A. 循環物質E為水
B. 乙池中Cu電極為陰極,發生還原反應
C. 甲池中的電極反應式為Cu2++2e-=Cu
D. 若外電路中通過1mol電子,兩電極的質量差為64g
查看答案和解析>>
科目: 來源: 題型:
【題目】設 NA 為阿伏加德羅常數的數值,下列說法正確的是
A.22.4 L 乙烷中所含的極性共價鍵數目為 7NA
B.某溫度下,將 1molCl2 通入足量水中轉移電子數為 NA
C.常溫常壓下,3.0 g 含葡萄糖的冰醋酸中含有的原子總數為 0.4NA
D.室溫下,1LpH 為 13 的 NaOH 溶液和 Ba(OH)2 混合溶液中含 OH-個數為 0.01NA
查看答案和解析>>
科目: 來源: 題型:
【題目】合成氨對人類的生存和發展有著重要意義,1909年哈伯在實驗室中首次利用氮氣與氫氣反應合成氨,實現了人工固氮。
(1)反應N2(g)+3H2(g)![]() 2NH3(g)的化學平衡常數表達式為__。
2NH3(g)的化學平衡常數表達式為__。
(2)請結合下列數據分析,工業上選用氮氣與氫氣反應固氮,而沒有選用氮氣和氧氣反應固氮的原因是__。
序號 | 化學反應 | K(298K)的數值 |
① | N2(g)+O2(g) | 5×10-31 |
② | N2(g)+3H2(g) | 4.1×106 |
(3)某實驗室在三個不同條件的密閉容器中,分別加入濃度均為c(N2)=0.100mol/L,c(H2)=0.300mol/L的反應物進行合成氨反應,N2的濃度隨時間的變化如圖①、②、③曲線所示。
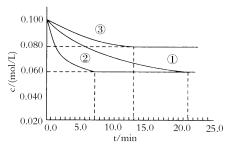
實驗②平衡時H2的轉化率為__。
據圖所示,②、③兩裝置中各有一個條件與①不同。請指出,并說明判斷的理由。
②條件:___理由:___。
③條件:___理由:___。
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)氫氧化鋇是一種使用廣泛的化學試劑。某課外小組通過下列實驗測定某試樣中Ba(OH)2·8H2O的含量。稱取3.50g試樣溶于蒸餾水配成100mL溶液,從中取出10.00mL溶液于錐形瓶中,加2滴指示劑,用0.1000mol/LHCl標準溶液滴定至終點,共消耗標準液20.00mL(雜質不與酸反應),求試樣中氫氧化鋇的物質的量為___;試樣中Ba(OH)2·8H2O的質量分數為___。
(2)維爾納配合物M是一種橙黃色單斜晶體,該晶體以濃氨水、雙氧水、CoCl2·6H2O、NH4Cl為原料在加熱條件下通過活性炭的催化來合成。為探究該晶體的組成,設計了如下圖實驗:
有一個步驟是氮的測定:準確稱取一定量橙黃色晶體,加入適量水溶解,注入如圖所示的三頸瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸氣,將樣品中的氨全部蒸出,用500.00mL7.0mol/L的鹽酸溶液吸收,吸收結束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定過量的鹽酸,終點消耗NaOH溶液12.50mL。
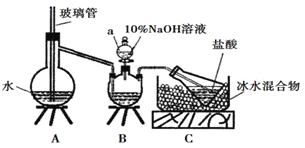
①上述裝置A中,玻璃管的作用是__;
②裝置A、B三腳架處應放置一個酒精燈作為熱源,酒精燈應放置在__(填“A”或“B”)處。
③步驟一所稱取的樣品中含氮的質量為__g(計算結果保留2位有效數字)
④有同學提出裝置C中所用鹽酸的濃度過大易揮發,會造成測得氮的含量結果將__(填“偏高”“偏低”或“無影響”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】甲醇作為燃料,在化石能源和可再生能源時期均有廣泛的應用前景。
I. 甲醇可以替代汽油和柴油作為內燃機燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa時,1 mol C8H18(l)完全燃燒生成氣態二氧化碳和液態水,放出5518 kJ熱量。該反應的熱化學方程式為______。
(2)已知:25℃、101 kPa時,CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol。相同質量的甲醇和辛烷分別完全燃燒時,放出熱量較多的是______。
(3)某研究者分別以甲醇和汽油做燃料,實驗測得在發動機高負荷工作情況下,汽車尾氣中CO的百分含量與汽車的加速性能的關系如右所示。
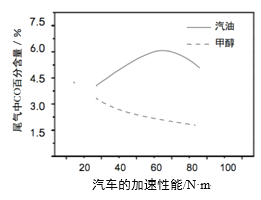
根據圖信息分析,與汽油相比,甲醇作為燃料的優點是______。
II. 甲醇的合成
(4)以CO2(g)和H2(g)為原料合成甲醇,反應的能量變化如下圖所示。

① 補全上圖:圖中A處應填入______。
② 該反應需要加入銅-鋅基催化劑。加入催化劑后,該反應的ΔH______(填“變大”“變小”或“不變”)。
(5)已知: CO(g)+1/2 O2(g) ==== CO2(g) ΔH1=-283 kJ/mol
H2(g)+1/2 O2(g) ==== H2O(g) ΔH2=-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
以CO(g)和H2(g)為原料合成甲醇的反應為CO(g) + 2H2(g) ==== CH3OH(g) 。該反應的ΔH為_____ kJ/mol。
查看答案和解析>>
科目: 來源: 題型:
【題目】氧化鋁陶瓷常用于厚膜集成電路,制備氧化鋁陶瓷的工藝流程如圖所示,回答下列問題。
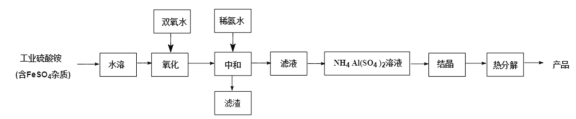
(1)“氧化”步驟發生的離子方程式為:________, 使用雙氧水作氧化劑優點為:______________。
(2)“熱分解”得到的產物除了氧化鋁外,還有 NH3、N2、SO2、SO3、H2O 生成,則氧化 產物和還原產物的物質的量之比為______________。
(3)銨明礬晶體的化學式為NH4Al(SO4)2·12H2O,“熱分解”步驟中,其各溫度段內受熱“失
重計算值( 失重計算值(%)![]() )如表所示:
)如表所示:
溫度區間(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重計算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通過上述數據經粗略計算可判斷,在______________溫度區間銨明礬基本上失去了全部結晶水。
(4)“結晶”步驟中常采用的操作是_____
(5)該流程中常使用過量的工業硫酸銨,利用硫酸銨水解使溶液顯酸性抑制硫酸鋁水解, 這樣做的目的是:______________。
(6)通常認為金屬離子濃度等于 1×10-5mol/L 即可認為沉淀完全,試計算常溫下“中和”步 驟中需要調節溶液 pH=______________(保留一位小數,已知:Ksp[Fe(OH)3 ]=8.0×10-38, lg5=0.7)。
查看答案和解析>>
科目: 來源: 題型:
【題目】醋酸、鹽酸是生活中常見的物質。
(1)25℃時,濃度均為0.1mol·L-1的鹽酸和醋酸溶液,下列說法正確的是___。
a.兩溶液的pH相同
b.兩溶液的導電能力相同
c.兩溶液中由水電離出的c(OH-)相同
d.中和等物質的量的NaOH,消耗兩溶液的體積相同
(2)25℃時,pH均等于4的醋酸溶液和鹽酸溶液,醋酸溶液中水電離出的H+濃度與鹽酸溶液中水電離出的H+濃度之比是___。
(3)醋酸溶液中存在電離平衡:CH3COOH![]() CH3COO-+H+,下列敘述不正確的是___。
CH3COO-+H+,下列敘述不正確的是___。
a.CH3COOH溶液中離子濃度關系滿足:c(H+)=c(OH-)+c(CH3COO)
b.0.1mol·L-1的CH3COOH溶液加水稀釋,溶液中c(OHˉ)減小
c.CH3COOH溶液中加入少量CH3COONa固體,平衡逆向移動
d.常溫下,pH=2的CH3COOH溶液與pH=12的NaOH溶液等體積混合后溶液的pH>7
e.室溫下pH=3的醋酸溶液加水稀釋,溶液中![]() 不變
不變
(4)常溫下,有pH相同、體積相同的醋酸和鹽酸兩種溶液,采取以下措施:
a.加水稀釋10倍后,醋酸溶液中的c(H+)__(填“>”“=”或“<”)鹽酸溶液中的c(H+)。
b.加等濃度的NaOH溶液至恰好中和,所需NaOH溶液的體積:醋酸__(填“>”“=”或“<”)鹽酸。
c.使溫度都升高20℃,溶液中c(H+):醋酸__(填“>”“=”或“<”)鹽酸。
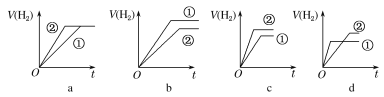
d.分別與足量的鋅粉發生反應,下列關于氫氣體積(V)隨時間(t)變化的示意圖正確的是__(填字母)。(①表示鹽酸,②表示醋酸)
(5)將0.1mol·L-1的CH3COOH加水稀釋,有關稀釋后醋酸溶液的說法中,正確的是__(填字母)。
a.電離程度增大
b.溶液中離子總數增多
c.溶液導電性增強
d.溶液中醋酸分子增多
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com