
科目: 來源: 題型:
【題目】A、B、C、D、E代表5種元素。請填空:
(1)A元素基態原子的最外層有3個未成對電子,次外層有2個電子,其元素符號為______
(2)B元素的![]() 價離子和C元素的
價離子和C元素的![]() 價離子的核外電子排布情況均與氬原子相同,則B元素的
價離子的核外電子排布情況均與氬原子相同,則B元素的![]() 價離子的結構示意圖為______,C元素原子有______個能層,______個能級,______個非空原子軌道
價離子的結構示意圖為______,C元素原子有______個能層,______個能級,______個非空原子軌道
(3)D元素的![]() 價離子的3d能級為半充滿狀態,D的元素符號為______,其基態原子的核外電子排布式為______
價離子的3d能級為半充滿狀態,D的元素符號為______,其基態原子的核外電子排布式為______
(4)E元素基態原子的M層全充滿,N層只有一個電子,E的元素符號為______,其基態原子的簡化電子排布式為______
查看答案和解析>>
科目: 來源: 題型:
【題目】在催化劑、400℃時可實現氯的循環利用,下圖是其能量關系圖下列分析正確的是
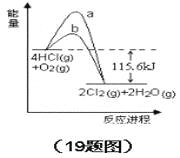
A. 曲線a是使用了催化劑的能量變化曲線
B. 反應物的總鍵能高于生成物的總鍵能
C. 反應的熱化學方程式為:4HCl(g)+O2(g) = 2Cl2+2H2O(g)△H=-115.6 kJ
D. 若反應生成2mol液態水,放出的熱量高于115.6kJ
查看答案和解析>>
科目: 來源: 題型:
【題目】下列基態原子或離子的電子排布式(圖)正確的是______(填序號,下同),違反能量最低原理的是______,違反洪特規則的是______,違反泡利原理的是______.
①![]() :
:![]()
②![]() :
:![]()
③P: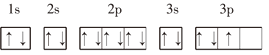
④Cr:![]()
⑤Fe:![]()
⑥![]() :
:![]()
⑦O: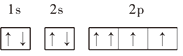
查看答案和解析>>
科目: 來源: 題型:
【題目】有A、B、C、D四種短周期主族元素,它們的原子序數依次增大,其中A元素原子核外電子僅有一種原子軌道,也是宇宙中最豐富的元素,B元素原子核外p電子數比s電子數少1,C為金屬元素且原子核外p電子數和s電子數相等,D元素的原子核外所有p軌道全充滿或半充滿。
(1)寫出四種元素的元素符號:
A________,B________,C________,D________。
(2)寫出C、D兩種元素基態原子核外電子軌道表示式。
C_______________________________________________________________,
D_______________________________________________________________。
(3)寫出B、C兩種元素單質在一定條件下反應的化學方程式____________________________________________。
(4)寫出B元素單質和氫化物的電子式:單質________,氫化物__________。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知![]() 的3d軌道上有5個電子,試回答:
的3d軌道上有5個電子,試回答:
(1)M元素原子的核外電子排布式為________
(2)M元素原子的最外層電子數為______,價層電子數為______
(3)M元素在元素周期表中的位置為______
查看答案和解析>>
科目: 來源: 題型:
【題目】下圖可設計成多種用途的電化學裝置。下列分析正確的是
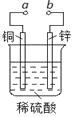
A.當a和b用導線連接時,溶液中的SO42-向銅片附近移動
B.將a與電源正極相連可以保護鋅片,這叫犧牲陽極的陰極保護法
C.當a和b用導線連接時,銅片上發生的反應為:2H++2e-=H2↑
D.a和b用導線連接后,電路中通過0.02mol電子時,產生0.02mol氣體
查看答案和解析>>
科目: 來源: 題型:
【題目】已知X、Y和Z三種元素的原子序數之和等于42。X元素原子的4p軌道上有3個未成對電子,Y元素原子的最外層2p軌道上有2個未成對電子。X與Y可形成化合物![]() ,Z元素可形成負一價離子。下列說法正確的是( )
,Z元素可形成負一價離子。下列說法正確的是( )
A.X元素原子的基態電子排布式為![]()
B.X元素是第四周期第ⅤA族元素
C.Y元素原子的電子排布圖為![]()
D.Z元素的單質![]() 在氧氣中不能燃燒
在氧氣中不能燃燒
查看答案和解析>>
科目: 來源: 題型:
【題目】某興趣小組用合金鋁、鐵、銅的廢棄合金為原料制取硝酸銅晶體和氫氧化鋁,并測定硝酸銅晶體的結晶水含量和氫氧化鋁的純度,設計的主要流程如下:
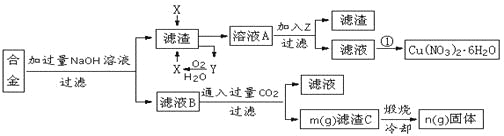
已知:
Fe2+沉淀的pH范圍為7.0~9.0;Fe3+沉淀的pH范圍為1.9~3.2;Cu2+沉淀的pH范圍為4.7~6.7
回答下列問題:
(1)寫出合金中加入NaOH溶液后所發生的離子反應方程式_______________________。試劑X的名稱為______________。
(2)加入Z的作用是調節溶液的pH,pH范圍應為_____;下列可作為試劑Z的是_______。
a.銅粉 b.氨水 c.氧化銅 d.硫酸銅
(3)實驗操作①依次是_________、_________、過濾洗滌即可得硝酸銅晶體。
(4)測定硝酸銅晶體的結晶水含量,下列方案中肯定不可行的是______。(選填編號)
a.稱量樣品→加熱→冷卻→稱量CuO
b.稱量樣品→加熱→冷卻→稱量Cu(NO3)2
c.稱量樣品→加熱→用已知質量的無水氯化鈣吸收水蒸氣并稱量
d.稱量樣品→加過量已知量的NaOH溶液→選用酚酞指示劑用標準鹽酸滴定
(5)根據流程圖內數據計算:濾渣C中氫氧化鋁的質量分數為______________________。(用m、n的代數式表示)
(6)按該流程的操作步驟,氫氧化鋁質量分數的測定結果偏高的可能性是最大的,原因有_______________________________;____________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】“臭蘇打”是硫化鈉的俗名,又稱臭堿,黃堿,硫化堿,具有臭味,硫化鈉溶解于冷水,極易溶于熱水,微溶于醇,是重要的化工產品。
(1)硫化鈉水溶液具有臭味是S2-水解產生H2S造成的,用離子方程式解釋_____________。
(2)Na2S具有較強的還原性,其水溶液在空氣中會緩慢地氧化成硫代硫酸鈉,寫出化學方程式__________________________________。
(3)某學習小組設計實驗探究金屬硫化物的性質。
Ⅰ.探究Na2S的還原性
甲同學取少量硫化鈉溶液于試管,滴加2滴酚酞溶液,再滴加溴水溶液,觀察到溶液顏色變淺。
①酚酞的作用是____________;寫出該實驗的離子方程式____________________
②乙同學認為甲方案不嚴密。他設計方案:取少量硫化鈉溶液于試管,滴加適量苯,再用長滴管加入溴水。加入“苯”的目的是_________________________
Ⅱ.探究氧化還原反應和沉淀反應的競爭
丙同學設計以下兩組實驗:
實驗1、①在10 mL 2 mol·L-1FeCl3溶液中滴加2 mL 1 mol·L-1Na2S溶液,觀察到有淺黃色沉淀生成,溶液黃色變淺。
②在10mL 2 mol·L-1Na2S溶液中滴加2mL1 mol·L-1FeCl3溶液。觀察到先產生淺黃色固體,隨后生成黑色固體,溶液黃色變無色。
實驗2、在2 mol·L-1Na2S溶液中滴加少量AgNO3溶液,立即產生大量黑色沉淀,沒有淺黃色沉淀。
實驗1 中產生的淺黃色固體是_______(填化學式)。寫出實驗1 ②中產生黑色沉淀的離子方程式_____________;已知:氧化性有Ag+>Fe3+,實驗2中,發生復分解反應,未發生氧化還原反應。
實驗結論:若某一溶液中同時存在氧化還原反應和沉淀反應,則_________(填“氧化還原”或“生成更難溶物質”)反應將優先進行。
查看答案和解析>>
科目: 來源: 題型:
【題目】無水四氯化錫(SnCl4)常用作有機合成的氯化催化劑,實驗室可用“溢流法”連續制備。SnCl4易揮發,極易發生水解,Cl2極易溶于SnCl4。制備原理與實驗裝置如圖所示:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1

可能用到的有關數據如下:
物質 | Sn | SnCl4 | CuCl2 |
熔點/℃ | 232 | -33 | 620 |
沸點/℃ | 2260 | 114 | 993 |
制備過程中,錫粒逐漸被消耗,須提拉橡膠塞及時向反應器中補加錫粒。當SnCl4液面升至側口高度時,液態產物經側管流入接收瓶。回答下列問題:
(1)Sn在周期表中的位置為_______________
(2)a管的作用是_______________,A中反應的離子方程式是______________。
(3)裝置D的作用是________________,裝置E中冷卻水的作用是___________。
(4)加熱Sn粒之前要先讓氯氣充滿整套裝置,其目的是___________________。
(5)錫粒中含銅雜質致E中產生CuCl2,但不影響F中產品的純度,原因是________。實驗所得SnCl4因溶解了Cl2而略顯黃色,提純SnCl4的方法是____(填序號)。
a.用NaOH溶液洗滌再蒸餾 b.升華 c.蒸餾 d.過濾
(6)尾氣處理時,可選用的裝置是________(填序號)。

(7)SnCl4在空氣中與水蒸氣反應除生成白色SnO2·xH2O固體,還可以看到大量白霧,化學方程式為___________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com