
科目: 來源: 題型:
【題目】化合物G是合成某種哮喘藥的中間體,G的合成路線如圖,請回答下列問題:
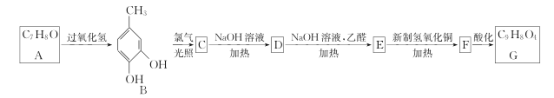
已知:I.化合物A的核磁共振氫譜有4組吸收峰。
II.通常情況下,在同一個碳原子上連有兩個羥基不穩定,易脫水形成羰基。
III.醛能發生羥醛縮合反應,再脫水生成不飽和醛:
RCH2-CHO+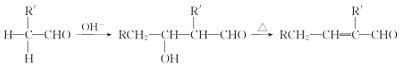 +H2O
+H2O
Ⅳ.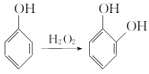
(1)A的結構簡式是__,名稱是__,1molA完全燃燒消耗氧氣的物質的量為___mol。
(2)B生成C的化學方程式是___。
(3)E生成F的反應類型是__。
(4)G中含氧官能團的名稱是__。
(5)符合下列條件的B的同分異構體共有__種。
①能與氯化鐵溶液發生顯色反應
②'H-NMR譜顯示分子中苯環上有2種不同化學環境的氫原子
(6)以乙醇為原料可合成有機物CH3CH=CHCOOC2H5,請參考上述流程設計合成路線(無機試劑任選)。___。
查看答案和解析>>
科目: 來源: 題型:
【題目】氧氣是一種清潔能源,氧氣的制取與儲存是氫能源利用領域的研究熱點。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=206.2 kJ![]()
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=247.4 kJ![]()
2H2S(g)=2H2(g)+S2(g)ΔH=169.8 kJ![]()
以甲烷為原料制取氫氣是工業上常用的制氫方法。CH4與 H2O(g)反應生成CO2(g)和 H2(g)的熱化學方程式為_______。
查看答案和解析>>
科目: 來源: 題型:
【題目】2SO2(g)+O2(g)=2SO3(g)反應過程的能量變化如圖所示。已知1mol SO2(g)氧化為1mol SO3(g)的ΔH=-99 kJ·![]() 。請回答下列問題:
。請回答下列問題:
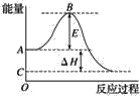
(1)圖中A、C分別表示__,E的大小對該反應的反應熱__(填“有”或“無”)影響.該反應通常用V2O5作催化劑,加V2O5會使圖中B點__(填“升高”或“降低”),ΔH__(填“變大”“變小”或“不變”)。
(2)圖中ΔH=__kJ·![]() 。
。
查看答案和解析>>
科目: 來源: 題型:
【題目】為了探究NO2與過氧化鈉反應的情況,甲、乙兩位同學設計了如下實驗,其裝置如圖。

已知:2NO2+2NaOH==NaNO3+NaNO2+H2O
試回答下列問題:
(1)儀器A的名稱是________________,儀器B的作用是________________________。
(2)裝入藥品前必須檢查裝置的氣密性,具體操作方法是________________________。
(3)試管中生成NO2反應的離子方程式是________________________________________。
(4)實驗過程中,兩位同學通過檢驗得知氣體產物中含有較多氧氣。該同學通過查閱資料了解NO2具有氧化性,據此甲同學判斷NO2與過氧化鈉反應可得到氧氣,而乙同學認為該結論不合理,理由是__________。為驗證自己的想法,乙同學對上述裝置進行了改進,具體做法是________________。
(5)改進裝置后,再進行實驗,兩位同學發現過氧化鈉的顏色由淡黃色逐漸變成白色,且檢驗不出氧氣的生成,該反應的化學方程式為________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】研究發現,鋁元素能損害人的腦細胞。適當地補充碘元素可預防甲狀腺腫大,但攝入過多也會導致甲狀腺腫大,因此補充人體所需的元素時也要適可而止。試回答下列問題:
(1)Fe也是人體需要補充的元素之一,試寫出Fe2+的核外電子排布式:__。
(2)與Al同一周期的Na、Mg元素也是人體所需元素,Na、Mg、Al基態原子第一電離能的大小關系是__。
(3)氯化鋁的熔點是194℃,氧化鋁的熔點是2054℃,但是工業上不能用電解熔融氯化鋁的方法獲取鋁單質,這是因為__。
(4)F與I是同一主族的元素,BeF2與H2O都是由三個原子構成的共價化合物分子,二者分子中的中心原子Be和O的雜化方式分別為__、__,BeF2分子的立體構型是___,H2O分子的立體構型是__。
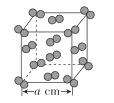
(5)I2晶體的晶胞結構如圖所示,該晶胞中含有__個I2分子,設該晶胞的晶胞參數為acm,則I2的密度是__g·cm-3。
查看答案和解析>>
科目: 來源: 題型:
【題目】利用如圖所示裝置測定中和熱的實驗步驟如下:
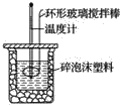
①用量筒量取50 mL 0.50 mol·L-1鹽酸倒入小燒杯中,測出鹽酸的溫度,然后把溫度計上的酸用水沖洗干凈;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用同一溫度計測出其溫度;③將NaOH溶液倒入小燒杯中,設法使之混合均勻,測得混合液最高溫度。回答下列問題:
(1)使鹽酸與NaOH溶液混合均勻的正確操作是________(填序號)。
A.用溫度計小心攪拌
B.揭開硬紙片用玻璃棒攪拌
C.輕輕地振蕩燒杯
D.用套在溫度計上的環形玻璃攪拌棒輕輕地攪動
(2)假設鹽酸和氫氧化鈉溶液的密度都是1 g·cm-3,又知中和反應后生成溶液的比熱容c=4.18 J·g-1·℃-1。為了計算中和熱,某學生實驗記錄數據如下:
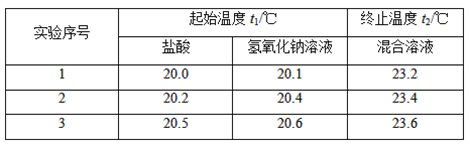
依據該學生的實驗數據計算,該實驗測得的中和熱ΔH=________(結果保留一位小數)。
(3)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氫氧化鈉溶液和鹽酸,理由是_______
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖所示,在800 mL的大燒杯中放入碎紙屑把盛有50 mL 0.50 mol·L-1鹽酸的100 mL燒杯放到大燒杯中,兩只燒杯間填滿碎紙屑。用泡沫塑料板做成大燒杯蓋,通過蓋子插入一根環形玻璃攪拌棒和一支溫度計,測定溶液的溫度。迅速往鹽酸中加入 50 mL 0.55 mol·L-1NaOH溶液,蓋好蓋子,攪拌溶液,觀察溫度的變化。當溫度保持穩定時,記錄讀數,取出裝有反應液的燒杯,倒出溶液,清洗干凈,保持內外杯壁干燥。重復進行三次實驗。用這一實驗可以粗略測定中和熱。
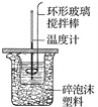
(1)燒杯間填滿碎紙屑的作用是____________。
(2)要重復進行三次實驗的目的是_____________。
(3)燒杯若不蓋泡沫塑料板,求得的中和熱數值將________(填“偏大”“偏小”或“無影響”)。
(4)實驗中若改用60 mL 0.50 mol·L-1鹽酸和50 mL 0.55 mol·L-1NaOH溶液進行上述反應,與上述實驗相比,所放出的熱量________(填“相等”或“不相等”),所求中和熱________(填“相等”或“不相等”),理由是_______。
(5)三次實驗測得的數據中,起始時鹽酸與NaOH溶液溫度相同,而終止溫度與起始溫度之差(t2-t1)分別為①2.3 ℃,②2.4 ℃,③2.5 ℃。則最終代入計算式的溫度差的平均值為________℃。
查看答案和解析>>
科目: 來源: 題型:
【題目】將![]() 和
和![]() 置于預先抽成真空的特制2L恒容密閉容器中,加熱至1500K,體系達到平衡,總壓強為
置于預先抽成真空的特制2L恒容密閉容器中,加熱至1500K,體系達到平衡,總壓強為![]() 體系中存在以下反應關系:
體系中存在以下反應關系:![]()
![]()
![]()
![]()
回答下列問題:
(1)![]() 與
與![]() 、
、![]() 、
、![]() 的關系是______。
的關系是______。
(2)![]() 反應過程中碘單質的轉化率隨時間的變化曲線如圖所示,A點時
反應過程中碘單質的轉化率隨時間的變化曲線如圖所示,A點時![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,前
,前![]() 的生成速率
的生成速率![]() ______。
______。
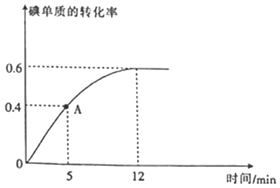
(3)達到平衡狀態時,氫氣的物質的量分數是______;![]() ______;
______;![]() ______
______![]() 保留2位有效數字
保留2位有效數字![]() 為用平衡分壓代替濃度表示的平衡常數,平衡分壓
為用平衡分壓代替濃度表示的平衡常數,平衡分壓![]() 總壓強
總壓強![]() 物質的量分數
物質的量分數![]() 。
。
(4)下列說法能說明該體系達到平衡狀態的是______。
A.顏色不再變化
B.氣體平均相對分子質量不再變化
C.氣體密度不再變化
D.溫度不再變化
(5)![]() 是一種強酸,常溫下將
是一種強酸,常溫下將![]() 的HI溶液和
的HI溶液和![]() 的氨水等體積混合后,溶液呈中性。此時溶液中離子濃度的大小關系是______。
的氨水等體積混合后,溶液呈中性。此時溶液中離子濃度的大小關系是______。
查看答案和解析>>
科目: 來源: 題型:
【題目】氯鹽可導致混凝土中的鋼筋腐蝕。為防止混凝土中的鋼筋腐蝕,可在混凝土表面敷置一定電解質溶液并將惰性金屬導電網浸泡其中,惰性金屬導電網與鋼筋分別連接外部直流電源從而除去Cl-,裝置如圖,下列說法錯誤的是
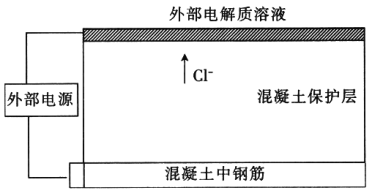
A. 鋼筋接電源的正極
B. 金屬導電網上發生的電極反應為2Cl—2e-=Cl2↑
C. 混凝土中的鈣離子向鋼筋方向移動
D. 電解一段時間后鋼筋附近溶液的pH增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com