
科目: 來源: 題型:
【題目】利用如圖所示的裝置和其他必要的儀器用品,完成下列實驗。

已知2NH3+3CuO![]() N2+3Cu+3H2O,該實驗證明氨氣具有還原性。
N2+3Cu+3H2O,該實驗證明氨氣具有還原性。
(1)堿石灰的作用是______________,倒扣漏斗的作用是___________________。
(2)濃氨水與固體NaOH接觸,會逸出大量氨氣原因是______________________。
(3)硬質玻璃管中可觀察到的實驗現象是_________________________________。
(4)常溫下,若氨水與稀硫酸恰好完全中和,則所得溶液中各離子濃度的大小順序為_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列離子方程式或化學反應方程式與所述事實相符且正確的是
A.將![]() 氣體通入一密閉容器中,達平衡后吸收QkJ熱量,則該反應的熱化學方程式為:
氣體通入一密閉容器中,達平衡后吸收QkJ熱量,則該反應的熱化學方程式為:![]()
B.將少量![]() 氣體通入NaClO溶液中:
氣體通入NaClO溶液中:![]()
C.![]() 溶液中加入
溶液中加入![]() 溶液使
溶液使![]() 完全沉淀:
完全沉淀:![]()
D.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反應:
充分反應:![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】下列各組熱化學方程式中,化學反應的ΔH前者大于后者的是 ( )
A.C(s)+O2(g)=CO2(g) ΔH1 C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
B.S(g)+O2(g)=SO2(g) ΔH3 S(l)+O2(g)=SO2(g) ΔH4
C. 2H2(g)+O2(g)=2H2O(l) ΔH5 H2(g)+![]() O2(g)=H2O(l) ΔH6
O2(g)=H2O(l) ΔH6
D.CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖為幾種晶體或晶胞的示意圖:


請回答下列問題:
(1)上述晶體中,粒子之間以共價鍵結合形成的晶體是____。
(2)冰、金剛石、MgO、CaCl2、干冰5種晶體的熔點由高到低的順序為:___。
(3)NaCl晶胞與MgO晶胞相同,NaCl晶體的晶格能___(填“大于”或“小于”)MgO晶體,原因是____。
(4)每個Cu晶胞中實際占有___個Cu原子,CaCl2晶體中Ca2+的配位數為__。
(5)冰的熔點遠高于干冰,除H2O是極性分子、CO2是非極性分子外,還有一個重要的原因是_____。
查看答案和解析>>
科目: 來源: 題型:
【題目】在體積為1L的密閉容器中![]() 體積不變
體積不變![]() 充入
充入![]() 和
和![]() ,一定條件下發生反應:
,一定條件下發生反應:![]() ,測得
,測得![]() 和
和![]() 的濃度隨時間變化如圖所示。下列說法正確的是
的濃度隨時間變化如圖所示。下列說法正確的是
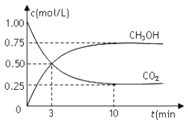
A.從反應開始到平衡,氫氣的平均反應速率為![]()
B.進行到3min時,正反應速率和逆反應速率相等
C.10min后容器中各物質的量濃度不再改變
D.到達平衡狀態時,反應放出![]() 的能量
的能量
查看答案和解析>>
科目: 來源: 題型:
【題目】某同學在實驗室進行鐵鹽與亞鐵鹽相互轉化的實驗:
實驗Ⅰ:將![]() 轉化為
轉化為![]() 如圖
如圖![]()
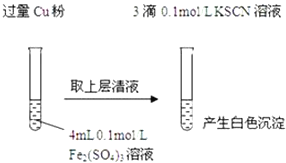
(1)Fe3+與Cu粉發生反應的離子方程式為______.
(2)探究白色沉淀產生的原因,請填寫實驗方案:查閱資料:
![]() 的化學性質與
的化學性質與![]() 相似,
相似,![]() 白色
白色![]()
實驗方案 | 現象 | 結論 |
步驟1:取4mL ______ | 產生白色沉淀 |
|
步驟2:取 ______ | 無明顯現象 |
![]() 與
與![]() 反應的離子方程式為______.
反應的離子方程式為______.
實驗Ⅱ:將![]() 轉化為
轉化為![]()
實驗方案 | 現象 |
向3mL | 溶液變為棕色,放置一段時間后,棕色消失,溶液變為黃色 |
探究上述現象出現的原因:查閱資料:![]() 棕色
棕色![]()
(3)用離子方程式解釋NO產生的原因______.
(4)從化學反應速率與限度的角度對體系中存在的反應進行
反應Ⅰ:![]() 與
與![]() 反應;反應Ⅱ:
反應;反應Ⅱ:![]() 與NO反應
與NO反應
①依據實驗現象,甲認為反應Ⅰ的速率比反應Ⅱ______![]() 填“快”或“慢”
填“快”或“慢”![]() .
.
②乙認為反應Ⅰ是一個不可逆反應,并通過實驗證明其猜測正確,乙設計的實驗方案是______.
③請用化學平衡移動原理解釋溶液由棕色變為黃色的原因______.
查看答案和解析>>
科目: 來源: 題型:
【題目】下列說法不正確的是
A.在固定體積的密閉容器中發生可逆反應![]() ,當混合氣體的壓強不再改變時,說明已達到化學平衡狀態
,當混合氣體的壓強不再改變時,說明已達到化學平衡狀態
B.對于反應![]()
![]() ,改變某一條件,若化學平衡常數增大,則反應速率也一定增大
,改變某一條件,若化學平衡常數增大,則反應速率也一定增大
C.將![]() 的
的![]() 加水稀釋,則溶液中
加水稀釋,則溶液中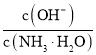 減小
減小
D.常溫下向![]() 懸濁液中加入
懸濁液中加入![]() 濃溶液后,溶液中
濃溶液后,溶液中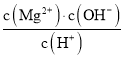 不變
不變
查看答案和解析>>
科目: 來源: 題型:
【題目】已知反應![]() 的能量變化如圖所示,下列說法正確的是
的能量變化如圖所示,下列說法正確的是
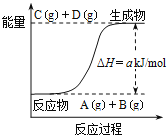
A.該體系的壓強不變時標志此反應處于平衡狀態
B.若該反應中有電子得失,則可設計成原電池
C.反應物的總鍵能高于生成物的總鍵能
D.該反應中的反應物A和B的轉化率一定相同
查看答案和解析>>
科目: 來源: 題型:
【題目】2﹣羥基異丁酸乙酯能溶于水,是一種應用于有機合成和藥物制造的化工原料。

(1)2﹣羥基異丁酸乙酯的分子式為_________,不同化學環境的氫在核磁共振氫譜圖中有不同的吸收峰,則2﹣羥基異丁酸乙酯有_________個吸收峰;
(2)①②的反應類型分別為_________,_________;
(3)已知I為溴代烴,I→B的化學方程式為_________;
(4)縮聚產物F的結構簡式為_________;
(5)下列關于![]() 和
和 的說法正確的有_________(雙選,填字母);
的說法正確的有_________(雙選,填字母);
A.后者遇到FeCl3溶液顯紫色,而前者不可
B.兩者都可以與NaHCO3溶液反應放出CO2
C.兩者都可以與氫氧化鈉溶液發生反應,當兩者物質的量相等時,消耗氫氧化鈉的量不相等
D.兩者都可以與氫氣發生加成反應
查看答案和解析>>
科目: 來源: 題型:
【題目】設![]() 為阿伏伽德羅常數的值,下列說法正確的有
為阿伏伽德羅常數的值,下列說法正確的有
①![]() 和
和![]() 在
在![]() 存在的條件下于密閉容器中加熱充分反應后,容器內物質分子數等于
存在的條件下于密閉容器中加熱充分反應后,容器內物質分子數等于![]()
②![]() 甲基
甲基![]() 所含電子數為
所含電子數為![]()
③在精煉銅或電鍍銅的過程中,當陰極析出32g銅轉移電子數均為![]()
④含![]() 的濃硫酸與足量銅反應,生成
的濃硫酸與足量銅反應,生成![]() 的分子數為
的分子數為![]()
⑤![]() 白磷晶體中含有的
白磷晶體中含有的![]() 鍵數是
鍵數是![]()
⑥![]() 的
的![]() 和
和![]() 混合物中,含硫原子總數為
混合物中,含硫原子總數為![]()
⑦![]() 過氧化鋇
過氧化鋇![]() 固體中陰、陽離子總數為
固體中陰、陽離子總數為![]()
A.2個B.3個C.4個D.5個
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com