
科目: 來源: 題型:
【題目】某溫度下,在一個2L的密閉容器中,加入4 molA和2molB進行如下反應:
3A(g)+2B(g)![]() 4C(s)+D(g),反應2 min后達到平衡,測得生成1.6 mol C,下列說法正確的是( )
4C(s)+D(g),反應2 min后達到平衡,測得生成1.6 mol C,下列說法正確的是( )
A. 前2min,D的平均反應速率為0.2mol/(L·min)
B. 此時,B的平衡轉化率是40%
C. 增加B,平衡向右移動,B的平衡轉化率增大
D. 增大該體系的壓強,平衡不移動
查看答案和解析>>
科目: 來源: 題型:
【題目】廣東省有著豐富的海洋資源。海水提取食鹽和Br2以后的鹽鹵可以用來制備純凈的MgCl2或MgO。鹽鹵中含有Mg2+、Cl-,還含有少量Na+、Fe2+、Fe3+和CO(NH2)2等.制備流程如圖所示:
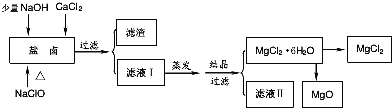
(1)濾渣的成分是____________(填化學式);濾液Ⅱ中所含的主要雜質離子是________(寫離子符號)。
(2)用NaClO除去尿素CO(NH2)2時,生成物除鹽外,都是能參與大氣循環的物質,則該反應的化學方程式為_____________________;
(3)用MgCl26H2O制備無水MgCl2過程中,所需要的化學試劑是___________________;
(4)海水制溴過程中吸收潮濕空氣中的Br2是利用SO2氣體,SO2吸收Br2的離子方程式是_______________;SO2氣體可來源于硫酸工業的尾氣,同時,SO2尾氣也可用氨水吸收,作為制備化肥的原料,SO2氣體用氨水吸收得到的產物可能是___________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】對于難溶鹽MX,其飽和溶液中M+和X-濃度之間的關系為Ksp=c(M+)c(X-),現將足量的AgCl分別放入下列物質中,AgCl的溶解度由大到小的順序是( )
①20mL0.01molL-1KCl溶液;②30mL0.02molL-1CaCl2溶液;③40mL0.03molL-1HCl溶液;④10mL蒸餾水;⑤50mL0.05molL-1AgNO3溶液
A.①>②>③>④>⑤B.④>①>③>②>⑤
C.⑤>④>②>①>③D.④>③>⑤>②>①
查看答案和解析>>
科目: 來源: 題型:
【題目】為了保護環境,充分利用資源,某研究小組通過如下簡化流程,將工業制硫酸的硫鐵礦渣(鐵主要以Fe2O3存在)轉變成重要的化工原料FeSO4(反應條件略)。
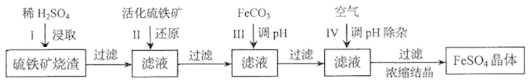
活化硫鐵礦還原Fe3+的主要反應為:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考慮其他反應。請回答下列問題:
(1)第Ⅰ步H2SO4與Fe2O3反應的離子方程式是_____________________。
(2)檢驗第Ⅱ步中Fe3+是否完全還原,應選擇_________________(填字母編號)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3調溶液pH到5.8左右,然后在第Ⅳ步通入空氣使溶液pH降到5.2,此時Fe2+不沉淀,濾液中鋁、硅雜質除盡。通入空氣引起溶液pH降低的原因是_______________。
(4)FeSO4在一定條件下可制得FeS2(二硫化亞鐵)納米材料。該材料可用于制造高容量鋰電池,電池放電時的總反應為4Li+ FeS2=Fe+2Li2S,正極反應式是___________。
(5)FeSO4可轉化為FeCO3,FeCO3在空氣中加熱反應可制得鐵系氧化物材料。
已知25℃,101kPa時:4Fe(s)+ 3O2 (g)=2Fe2O3(s)H=-1648kJ/mol
C(s)+O2(g)=CO2(g)H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)H =-1480kJ/mol
FeCO3在空氣中加熱反應生成Fe2O3的熱化學方程式是______________。
(6)假如燒渣中的鐵全部視為Fe2O3,其含量為p。將b kg質量分數為c的硫酸加入到a kg燒渣中浸取,鐵的浸取率為q,其他雜質浸出消耗的硫酸以及調pH后溶液呈微酸性所殘留的硫酸忽略不計。按上述流程,第Ⅲ步應加入FeCO3___________kg。
查看答案和解析>>
科目: 來源: 題型:
【題目】磷精礦濕法制備磷酸的一種工藝流程如下:

已知:磷精礦主要成分為Ca5(PO4)3(OH),還含有Ca5(PO4)3F和有機碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反應速率的措施有__________。
(2)磷精礦粉酸浸時發生反應:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①該反應體現出酸性關系:H3PO4__________H2SO4(填“>”或“<”)。
②結合元素周期律解釋①中結論:P和S電子層數相同,__________。
(3)酸浸時,磷精礦中Ca5(PO4)3F所含氟轉化為HF,并進一步轉化為SiF4除去。寫出生成HF的化學方程式:__________。
(4)H2O2將粗磷酸中的有機碳氧化為CO2脫除,同時自身也會發生分解。相同投料比、相同反應時間,不同溫度下的有機碳脫除率如圖所示。80℃后脫除率變化的原因:____________________。

(5)脫硫時,CaCO3稍過量,充分反應后仍有SO42殘留,原因是__________;加入BaCO3可進一步提高硫的脫除率,其離子方程式是____________________。
(6)取a g所得精制磷酸,加適量水稀釋,以百里香酚酞作指示劑,用b mol·L1NaOH溶液滴定至終點時生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的質量分數是________。(已知:H3PO4摩爾質量為98 g·mol1)
查看答案和解析>>
科目: 來源: 題型:
【題目】下列反應的離子方程式書寫正確的是()
A. 氧化銅與稀硝酸反應:CuO + 2H+ ![]() Cu2+ + H2O
Cu2+ + H2O
B. 稀 H2SO4與鐵粉反應:2Fe + 6H+ ![]() 2Fe3+ + 3H2↑
2Fe3+ + 3H2↑
C. 鹽酸滴在石灰石上:2H++ CO32— ![]() H2O +CO2↑
H2O +CO2↑
D. 硫酸氫鈉與過量氫氧化鋇反應:Ba2++2OH—+ 2H+ +SO42—![]() BaSO4↓+ 2H2O
BaSO4↓+ 2H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】影響化學反應速率的因素很多,某校化學小組用實驗的方法進行探究。
實驗一:他們只利用Cu、Fe、Mg和不同濃度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)設計實驗方案來研究影響化學反應速率的因素。甲同學的實驗報告如下表:
實驗步驟 | 現象 | 結論 |
①分別取等體積的2 mol·L-1的硫酸于試管中 | 反應速率Mg>Fe,Cu不反應 | 金屬的性質越活潑,反應速率越快 |
②____________ | 反應物濃度越大,反應速率越快 |
(1)甲同學表中實驗步驟②為_________________________________________。
(2)甲同學的實驗目的是_____________;要得出正確的實驗結論,還需控制的實驗條件是____________。乙同學為了更精確地研究濃度對反應速率的影響,利用如圖所示裝置進行定量實驗。

(3)乙同學在實驗中應該測定的數據是___________________________________________________。
(4)乙同學完成該實驗應選用的實驗藥品是________,該實驗中不選用某濃度的硫酸,理由是___________。
實驗二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高錳酸鉀酸性溶液和草酸溶液反應時,發現開始一段時間,反應速率較慢,溶液褪色不明顯;但不久突然褪色,反應速率明顯加快。
(5)針對上述實驗現象,丙同學認為KMnO4與H2C2O4反應放熱,導致溶液溫度升高,反應速率加快。從影響化學反應速率的因素看,你猜想還可能是______________的影響。
(6)若用實驗證明你的猜想,除高錳酸鉀酸性溶液、草酸溶液外,還需要選擇的試劑最合理的是________(填字母)。
A.硫酸鉀 B.硫酸錳 C.二氯化錳 D.水
查看答案和解析>>
科目: 來源: 題型:
【題目】反應mX(g)![]() nY(g)+pZ(g) ΔH,在不同溫度下的平衡體系中物質Y的體積分數隨壓強變化的曲線如圖所示,下列說法錯誤的是( )
nY(g)+pZ(g) ΔH,在不同溫度下的平衡體系中物質Y的體積分數隨壓強變化的曲線如圖所示,下列說法錯誤的是( )

A. 該反應的ΔH>0
B. m<n+p
C. B、C兩點化學平衡常數:KB>KC
D. A、C兩點的反應速率v(A)<v(C)
查看答案和解析>>
科目: 來源: 題型:
【題目】汽車安全氣囊彈出時的反應為:![]() 下列說法正確的是( )
下列說法正確的是( )
A.自然界中氮、鈉、硅元素均可以游離態形式存在
B.將反應后的固體溶于適量水,靜置,通入![]() ,無現象
,無現象
C.微粒的半徑:![]()
D.若反應中轉移![]() 電子,則消耗
電子,則消耗![]() 的質量為
的質量為![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com