
科目: 來源: 題型:
【題目】實驗室用![]() 與
與![]() 制取
制取![]() 氣體,再由
氣體,再由![]() 在強堿性條件下與過量的
在強堿性條件下與過量的![]() 反應制得漂白劑
反應制得漂白劑![]() 裝置如圖1所示
裝置如圖1所示![]() .
.
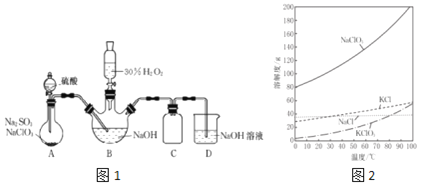
已知![]() 如圖
如圖![]() :
:![]() 飽和溶液在溫度低于
飽和溶液在溫度低于![]() 時析出的晶體是
時析出的晶體是![]() ,高于
,高于![]() 時析出晶體是
時析出晶體是![]() ;
;![]() Ⅱ
Ⅱ![]()
![]() 超過
超過![]() 時會完全分解;
時會完全分解;![]() Ⅲ
Ⅲ![]() 高于
高于![]() 時
時![]() 分解成
分解成![]() 和NaCl.
和NaCl.
![]() 圖1裝置A發生的反應中,還原劑是______.
圖1裝置A發生的反應中,還原劑是______.
![]() 圖1裝置B中反應生成
圖1裝置B中反應生成![]() 的化學方程式為______.
的化學方程式為______.
![]() 實驗中圖1裝置B需進行溫度控制不超過
實驗中圖1裝置B需進行溫度控制不超過![]() ,在不改變NaOH溶液濃度和體積的條件下,可采取的措施有______、______.
,在不改變NaOH溶液濃度和體積的條件下,可采取的措施有______、______.
![]() 請補充從圖1裝置B反應后的溶液中獲得
請補充從圖1裝置B反應后的溶液中獲得![]() 晶體的操作步驟.
晶體的操作步驟.
![]() 在
在![]() 時蒸發結晶;
時蒸發結晶;![]() ______;
______;![]() ______;
______;![]() ______;得到成品.
______;得到成品.
![]() 圖1裝置C的作用是______.
圖1裝置C的作用是______.
![]() 證明實驗后圖1裝置B所得混合溶液中的
證明實驗后圖1裝置B所得混合溶液中的![]() 具有氧化性的實驗方案是______
具有氧化性的實驗方案是______![]() 可供選用的試劑:稀
可供選用的試劑:稀![]() 、
、![]() 溶液、KSCN溶液
溶液、KSCN溶液![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】某同學用下面實驗裝置設計實驗制備SO2并進行相關探究活動。
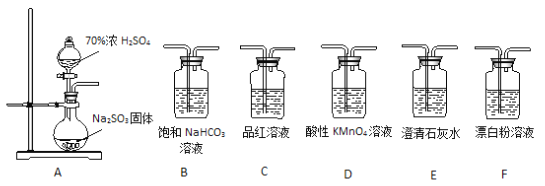
(1)裝置A中反應的化學方程式為________________________。
(2)甲同學認為利用上述裝置也可證明亞硫酸酸性強于次氯酸,請寫出正確的裝置連接順序:A→_________→_________→C→F。
(3)乙同學從上面裝置中選擇合適的裝置驗證亞硫酸與碳酸的酸性強弱,其中用到C、D裝置。則C裝置的作用是________________________,通過______________________現象即可證明亞硫酸酸性強于碳酸。
(4)丙同學將A中產生的足量的SO2通入下圖裝置G中,G中有白色沉淀生成。該沉淀的化學式為_________。
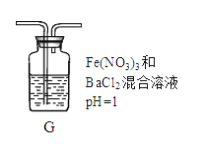
推測產生沉淀的原因可能是(不考慮空氣的影響)
原因一:SO2在酸性條件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:__________________。
若是原因二,需證明Fe3+的還原產物,其實驗操作及現象是________________________。
(5)實驗中發現Na2SO3可能部分變質,現需測定Na2SO3的純度,稱15.0 g Na2SO3樣品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液進行滴定,達到滴定終點時消耗KMnO4溶液20.00 mL。達到滴定終點時錐形瓶中溶液顏色變化是______________,樣品中Na2SO3質量分數是_____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】連二亞硫酸鈉![]() 俗稱保險粉,可以用作染色工藝的還原劑,紙漿、肥皂等的漂白劑。
俗稱保險粉,可以用作染色工藝的還原劑,紙漿、肥皂等的漂白劑。![]() 易溶于水,難溶于乙醇,在堿性介質中較穩定,在空氣中易被氧化。回答下列問題:
易溶于水,難溶于乙醇,在堿性介質中較穩定,在空氣中易被氧化。回答下列問題:
![]() 在潮濕空氣中氧化,生成的兩種常見酸式鹽是________
在潮濕空氣中氧化,生成的兩種常見酸式鹽是________![]() 填化學式
填化學式![]() 。
。
![]() 鋅粉法制備
鋅粉法制備![]() 的工藝流程如下圖所示:
的工藝流程如下圖所示:
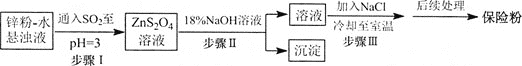
![]() 工業上常將鋅塊進行預處理得到鋅粉
工業上常將鋅塊進行預處理得到鋅粉![]() 水懸濁液,其目的是________。
水懸濁液,其目的是________。
![]() 步驟Ⅰ中發生反應的化學方程式為________。
步驟Ⅰ中發生反應的化學方程式為________。
![]() 在步驟Ⅲ中得到的
在步驟Ⅲ中得到的![]() 固體要用乙醇洗滌,其優點是________,“后續處理”最終要加入少量的
固體要用乙醇洗滌,其優點是________,“后續處理”最終要加入少量的![]() 固體,其原因是________。
固體,其原因是________。
![]() 目前,我國普遍采用甲酸鈉法生產連二亞硫酸鈉,其原理是先將HCOONa和燒堿加入乙醇水溶液中,然后通入
目前,我國普遍采用甲酸鈉法生產連二亞硫酸鈉,其原理是先將HCOONa和燒堿加入乙醇水溶液中,然后通入![]() 發生反應,有
發生反應,有![]() 氣體放出,總反應的離子方程式是________。
氣體放出,總反應的離子方程式是________。
![]() 有人設計了圖示方法同時制備連二亞硫酸鈉和過二硫酸鈉
有人設計了圖示方法同時制備連二亞硫酸鈉和過二硫酸鈉![]() ,并獲得中國專利。電解過程中,陰極室生成
,并獲得中國專利。電解過程中,陰極室生成![]() ,a極的電極反應式為________,通過陽離子交換膜的離子主要是
,a極的電極反應式為________,通過陽離子交換膜的離子主要是![]() ,其遷移方向是________。
,其遷移方向是________。

查看答案和解析>>
科目: 來源: 題型:
【題目】化工生產中常利用硫酸廠煅燒黃鐵礦石的燒渣(主要成分為鐵的氧化物及少量FeS、SiO2等)來制備聚鐵(堿式硫酸鐵的聚合物)和綠礬(FeSO4·7H2O),流程如圖:
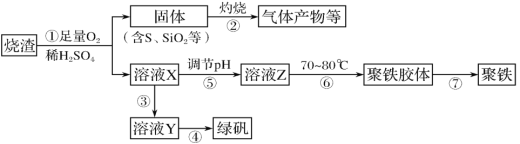
(1)將過程②中產生的氣體通入下列溶液中,溶液不褪色的是__(填選項序號)。
A.酸性KMnO4溶液 B.品紅溶液 C.紫色石蕊溶液 D.溴水
(2)過程①中,FeS和O2、H2SO4反應的化學方程式為__。
(3)過程③中,需加入的物質是__,反應的離子方程式為__。
(4)用溶液Y制綠礬時,檢驗溶液Y中是否含有Fe3+的操作是__。
(5)在實驗室里,完成過程④中的操作名稱是__。
(6)實驗室為測量所得到的聚鐵樣品中鐵元素的質量分數,進行下列實驗:
①用分析天平稱取2.240g樣品;
②將樣品溶于足量的鹽酸后,加入過量的氯化鋇溶液;
③過濾、洗滌、干燥、稱量,得固體質量為2.330g。若該聚鐵的主要成分為[Fe(OH)SO4]n,則聚鐵樣品中鐵元素的質量分數為__。(假設雜質中不含鐵元素和硫元素)
查看答案和解析>>
科目: 來源: 題型:
【題目】A、B、C、D、E是元素周期表中前四周期的五種常見元素,其原子序數依次增大。詳細信息見表,請回答下列問題:
① | A的一種核素在考古時常用來鑒定一些文物的年代 |
② | B的氧化物是導致光化學煙霧的主要物質之一 |
③ | C的某一種單質是空氣的主要成分之一 |
④ | D的基態原子核外有6個原子軌道處于半充滿狀態 |
⑤ | E能形成紅色的E2O和黑色的EO兩種氧化物 |
(1)D的價電子排布式可表示為_______。
(2)BC3-的空間構型為____ (用文字描述)。
(3)根據等電子原理,AC分子的結構式為_____。
(4)1 mol AC2中σ鍵、π鍵數目之比為____。
(5)將白色的ESO4溶解于水中,溶液呈藍色,是因為生成了一種呈藍色的配位數是4的配合離子。請寫出生成此配合離子的離子方程式:____。
(6)E2+能與NH3、H2O、Cl-等形成配位數為4的配合物。
①[E(NH3)4]2+中存在的化學鍵類型有____(填序號)。
A.配位鍵 B.離子鍵 C.極性共價鍵 D.非極性共價鍵
②[E(NH3)4]2+具有對稱的空間構型,[E(NH3)4]2+中的兩個NH3被兩個Cl-取代,能得到兩種不同結構的產物,則[E(NH3)4]2+的空間構型為_____。其中,配體的雜化類型是_____。
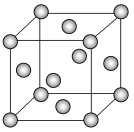
(7)E的晶胞如下圖所示,E為______堆積,空間利用率為_____,E晶體中每個E原子周圍距離最近的E原子數目為____;已知E原子的半徑為a nm,阿伏加德羅常數的值為NA,則E晶體的密度是_____g·cm-3。(列出算式即可)。
查看答案和解析>>
科目: 來源: 題型:
【題目】某興趣小組的同學用下圖所示裝置研究有關電化學的問題。當閉合該裝置的電鍵時,觀察到檢流計的指針發生了偏轉。
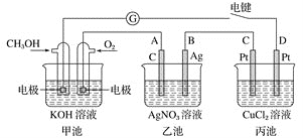
請回答下列問題:
(1)甲池為________(填“原電池”、“電解池”或“電鍍池”),通入CH3OH一極的電極反應式為_____________________________________________________________;
(2)乙池中A(石墨)電極的名稱為________(填“正極”、“負極”、“陰極”或“陽極”),總反應式為_________________________________________________________;
(3)當乙池中B極質量增加5.40 g時,甲池中理論上消耗O2的體積為________ mL(標準狀況),丙池中________極析出________ g銅;
(4)若丙中電極不變,將其溶液換成NaCl溶液,電鍵閉合一段時間后,甲中溶液的pH將________(填“增大”、“減小”或“不變”);丙中溶液的pH將________(填“增大”、“減小”或“不變”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】亞磷酸![]() 是二元酸,
是二元酸,![]() 溶液存在電離平衡:
溶液存在電離平衡:![]() 亞磷酸與足量NaOH溶液反應,生成
亞磷酸與足量NaOH溶液反應,生成![]() .
.

![]() 寫出亞磷酸與少量NaOH溶液反應的離子方程式 _______________;
寫出亞磷酸與少量NaOH溶液反應的離子方程式 _______________;
![]() 某溫度下,
某溫度下,![]() 的
的![]() 溶液pH的讀數為
溶液pH的讀數為![]() ,即此時溶液中
,即此時溶液中![]() ,除
,除![]() 之外其他離子的濃度由小到大的順序是 _____________,該溫度下
之外其他離子的濃度由小到大的順序是 _____________,該溫度下![]() 電離平衡的平衡常數
電離平衡的平衡常數![]() ___________。
___________。![]() 第二步電離忽略不計,結果保留兩位有效數字
第二步電離忽略不計,結果保留兩位有效數字![]()
![]() 向
向![]() 溶液中滴加NaOH溶液至中性,所得溶液中
溶液中滴加NaOH溶液至中性,所得溶液中![]() ___________
___________ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 亞磷酸具有強還原性,可使碘水褪色,該反應的化學方程式 _____________;
亞磷酸具有強還原性,可使碘水褪色,該反應的化學方程式 _____________;
![]() 電解
電解![]() 溶液也可得到亞磷酸,裝置示意圖如圖:說明:陽膜只允許陽離子通過,陰膜只允許陰離子通過。
溶液也可得到亞磷酸,裝置示意圖如圖:說明:陽膜只允許陽離子通過,陰膜只允許陰離子通過。
![]() 陰極的電極反應式為 ________________;
陰極的電極反應式為 ________________;
![]() 產品室中反應的離子方程式為 ______________。
產品室中反應的離子方程式為 ______________。
查看答案和解析>>
科目: 來源: 題型:
【題目】有四種短周期元素,它們的結構、性質等信息如下表所示:
元素 | 結構、性質等信息 |
A | 是元素周期表中(除稀有氣體外)原子半徑最大的元素,該元素某種合金是原子反應堆導熱劑 |
B | B與A同周期,其最高價氧化物的水化物呈兩性 |
C | 元素的氣態氫化物極易溶于水,可用作制冷劑 |
D | 是海水中除氫、氧元素外含量最多的元素,其單質或化合物也是自來水生產過程中常用的消毒殺菌劑 |
E | L層上有2對成對電子 |
請根據表中信息填寫:
(1)B原子的簡化電子排布式_____。
(2)A元素在周期表中的位置_____;離子半徑:A_____B(填>、=或< )。
(3)E原子的價電子排布圖是____,其原子核外有______個未成對電子,能量最高的電子為_____軌道上的電子,其軌道呈_____形。
(4)D原子的外圍電子排布式為____,D-的離子結構示意圖是_____。
(5)C、E元素的第一電離能的大小關系是_____(用元素符號表示,下同)。
(6)已知CD3分子中D元素為+1價,則C、D的電負性大小關系是____,CD3的中心原子雜化軌道類型是___,CD3與水反應的化學方程式是_____。
查看答案和解析>>
科目: 來源: 題型:
【題目】確定物質性質的重要因素是物質結構。請回答下列問題。
(1)A、B、C、D為四種晶體,性質如下:
A.固態、液態時均不導電,熔點-120 ℃,能溶于CS2
B.固態、液態時大多不導電,硬度很大,熔點為3500 ℃
C.固態和熔融態時都能導電,能溶于鹽酸
D.固態時不導電,液態時能導電,可溶于水
試推斷它們的晶體類型:
A.______; B.______; C._____; D._____。
(2)實驗證明:KCl、MgO、CaO、TiN這4種晶體的結構與NaCl晶體結構相似(如下圖所示,其中TiN中N呈-3價),已知其中3種離子晶體的晶格能數據如下表:
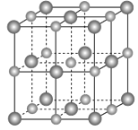
離子晶體 | KCl | MgO | CaO |
晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
則該4種離子晶體的熔點從高到低的順序是______。
(3)某離子X+中所有電子正好充滿K、L、M三個電子層,它與N3-形成晶體的結構如下圖所示。X的元素名稱是_____,X+的價電子排布式為_____,與同一個N3-相連的X+有_____個,這幾個X+所形成的空間構型為_____。
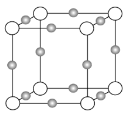
查看答案和解析>>
科目: 來源: 題型:
【題目】完成問題
![]() 通過如圖所示電解裝置可將
通過如圖所示電解裝置可將![]() 轉化為硫酸,電極材料皆為石墨。則A為電解池的_________
轉化為硫酸,電極材料皆為石墨。則A為電解池的_________![]() 填“陰極”或“陽極”
填“陰極”或“陽極”![]() 。C為________
。C為________![]() 填物質名稱
填物質名稱![]() 。若將陰離子交換膜換成陽離子交換膜,寫出陽極區域發生的電極反應:_______。
。若將陰離子交換膜換成陽離子交換膜,寫出陽極區域發生的電極反應:_______。

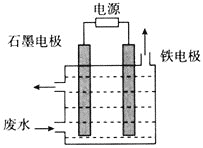
![]() 用如圖所示裝置處理含
用如圖所示裝置處理含![]() 廢水時,控制溶液pH為
廢水時,控制溶液pH為![]() 并加入NaCl,一定條件下電解,陽極產生的
并加入NaCl,一定條件下電解,陽極產生的![]() 將
將![]() 氧化為無害物質而除去。鐵電極為_________
氧化為無害物質而除去。鐵電極為_________![]() 填“陰極”或“陽極”
填“陰極”或“陽極”![]() ,陽極產生
,陽極產生![]() 的電極反應為_______,陽極產生的
的電極反應為_______,陽極產生的![]() 將
將![]() 氧化為無害物質而除去的離子方程式為______。
氧化為無害物質而除去的離子方程式為______。
![]() 以連二亞硫酸根離子
以連二亞硫酸根離子![]() 為媒介,使用間接電化學法也可處理燃煤煙氣中的NO,裝置如圖所示:
為媒介,使用間接電化學法也可處理燃煤煙氣中的NO,裝置如圖所示:

陰極區的電極反應式為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com