
科目: 來源: 題型:
【題目】0.1mol/L的NH4Cl溶液中,離子濃度關系正確的是
A.c(![]() )>c(Cl—)>c(H+)>c(OH—)
)>c(Cl—)>c(H+)>c(OH—)
B.c(![]() )>c(OH—)>c(Cl—)>c(H+)
)>c(OH—)>c(Cl—)>c(H+)
C.c(OH—)=c(Cl—)+c(H+)
D.c(![]() )+c(H+)=c(Cl—)+c(OH—)
)+c(H+)=c(Cl—)+c(OH—)
查看答案和解析>>
科目: 來源: 題型:
【題目】元素的基態原子的核外電子有3種能量狀態、5種空間狀態,X是其中第一電離能最小的元素;元素Y的M層電子運動狀態與X的價電子運動狀態相同;元素Z位于第四周期,其基態原子的2價陽離子M層軌道全部排滿電子。
(1)X基態原子的電子排布式為___________。
(2)X的氫化物(H2X)在乙醇中的溶解度大于H2Y,其原因是___________。
(3)在Y的氫化物(H2Y分子中,Y原子軌道的雜化類型是___________。
(4)Y與X可形成YX32-。
①YX32-的立體構型為___________(用文字描述)。
②寫出一種與YX32-互為等電子體的分子的化學式___________。
(5)Z的氯化物與氨水反應可形成配合物[Z(NH3)4(H2O)2]Cl2,該配合物加熱時,首先失去配離子中的配體是___________(寫化學式)。

(6)Y與Z所形成化合物晶體的晶胞如圖所示,該化合物的化學式為___________。其晶胞邊長為540.0pm,密度為___________g·cm-3(列式并計算),a位置Y與b位置Z之間的距離為___________pm(列式表示)
查看答案和解析>>
科目: 來源: 題型:
【題目】下列事實不能用平衡移動原理解釋的是
A. 開啟啤酒瓶后,瓶中馬上泛起大量泡沫
開啟啤酒瓶后,瓶中馬上泛起大量泡沫
B. 由H2(g)、I2(g)、HI(g)組成的平衡體系加壓后顏色變深
由H2(g)、I2(g)、HI(g)組成的平衡體系加壓后顏色變深
C.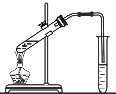 實驗室制取乙酸乙酯時,將乙酸乙酯不斷蒸出
實驗室制取乙酸乙酯時,將乙酸乙酯不斷蒸出
D. 石灰巖受地下水長期溶蝕形成溶洞
石灰巖受地下水長期溶蝕形成溶洞
查看答案和解析>>
科目: 來源: 題型:
【題目】A、B、C均為中學化學常見的純凈物,它們之間存在如下轉化關系:
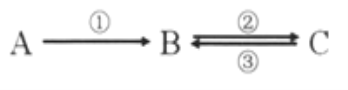
其中①②③均為有單質參與的反應。
(1)若A是常見的金屬,①③中均有同一種黃綠色氣體參與反應,B溶液遇KSCN顯血紅色,且②為化合反應,寫出反應②的離子方程式_________________________。
(2)如何檢驗上述C溶液中的陽離子?______________________。
(3)若B是太陽能電池用的光伏材料,①②③為工業制備B的反應。C的化學式是____________,屬于置換反應____________,(填序號)寫出反應①的化學方程式____________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】化學平衡常數(K)、電離常數(Ka、Kb)、水的離子積常數(Kw)、溶度積常數(Ksp)等常數是表示判斷物質性質的重要常數,下列關于這些常數的說法中,正確的是![]()
A.化學平衡常數的大小與溫度、濃度、壓強有關,與催化劑無關
B.Ka(HCN)<Ka(CH3COOH)說明相同物質的量濃度時,氫氰酸的酸性比醋酸的強
C.當溫度升高時,弱酸、弱堿的電離常數(Ka、Kb)和水的離子積常數(Kw)均變大
D.向氯化鋇溶液中加入等體積同濃度的碳酸鈉和硫酸鈉溶液,先產生![]() 沉淀,則Ksp(BaSO4)>Ksp(BaCO3)
沉淀,則Ksp(BaSO4)>Ksp(BaCO3)
查看答案和解析>>
科目: 來源: 題型:
【題目】為提升電池循環效率和穩定性,科學家近期利用三維多孔海綿狀Zn(3DZn)可以高效沉積ZnO的特點,設計了采用強堿性電解質的3DZn—NiOOH二次電池,結構如下圖所示。電池反應為Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三維多孔海綿狀Zn具有較高的表面積,所沉積的ZnO分散度高
B. 充電時陽極反應為Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放電時負極反應為Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放電過程中OH通過隔膜從負極區移向正極區
查看答案和解析>>
科目: 來源: 題型:
【題目】根據下列有關圖象,說法正確的是( )

A. 由圖Ⅰ知,反應在T1、T3處達到平衡,且該反應的ΔH<0
B. 由圖Ⅱ知,反應在t6時刻,NH3體積分數最大
C. 由圖Ⅱ知,t3時采取增大反應體系壓強的措施
D. 若圖Ⅲ表示在10 L容器、850℃時的反應,由圖知,到4 min時,反應放出51.6 kJ的熱量
查看答案和解析>>
科目: 來源: 題型:
【題目】超分子化學已逐漸擴展到化學的各個分支,還擴展到生命科學和物理學等領域。由Mo將2個C60分子、2個p-甲酸丁酯吡啶及2個CO分子利用配位鍵自組裝的超分子結構如圖所示。

(1)Mo處于第五周期第VIB族,核外電子排布與Cr相似,它的基態價電子排布式是___________;核外未成對電子數是___________個。
(2)該超分子中存在的化學鍵類型有___________。
A σ鍵 B π鍵 C 離子鍵 D 氫鍵
(3)該超分子中配體CO提供孤電子對的原子是___________(填元素符號),p-甲酸丁酯吡啶配體中C原子的雜化方式有___________。
(4)從電負性角度解釋CF3COOH的酸性強于CH3COOH的原因___________。
(5)C60與金剛石互為同素異形體,從結構與性質之間的關系解釋C60的熔點遠低于金剛石的原因是___________。
(6)已知:某晶胞中各原子的相對位置可用如圖所示的原子坐標表示,其中所有頂點原子坐標均為(0,0,0)。

鉬(Mo)的一種立方晶系的晶體結構中,每個晶胞有2個Mo原子,其中Mo原子坐標是(0,0,0)及(1/2,1/2,1/2)。根據以上信息,推斷該晶體的原子堆積方式是___________。已知該晶體的密度是ρg·cm-3,Mo的摩爾質量是M g·mol-1,阿伏加德羅常數是NA,晶體中距離最近的Mo原子核之間的距離為___________pm。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列解釋事實的離子方程式不正確的是
A.用石墨電極電解飽和食鹽水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.明礬可以做凈水劑:Al3++3H2O=Al(OH)3↓+3H+
C.向鐵制器具上電鍍銅,陰極的電極反應為:Cu2++2e-=Cu
D.向氫氧化鎂濁液中滴入酚酞溶液,溶液變紅:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
查看答案和解析>>
科目: 來源: 題型:
【題目】常見的太陽能電池有單晶硅或多晶硅太陽能電池、GaAs太陽能電池及銅銦鎵硒薄膜太陽能電池等。請回答下列問題:
(1)基態硒原子的價電子排布式為___;H2O的沸點高于H2Se的沸點(-42℃),其原因是___。
(2)已知GaCl3晶體熔點為77.9℃,沸點為201.3℃,GaCl3品體類型為____。
(3)Na3AsO4中陰離子的空間構型為_____,As原子采取_____雜化。
(4)高溫下CuO容易轉化為Cu2O,試從原子結構角度解釋原因:_____。
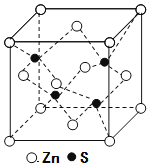
(5)鋅與銅位于同一周期。硫化鋅的晶胞結構如圖所示,S2-周圍等距離且最近的Zn2+個數為____;若晶胞邊長為dpm,則硫化鋅的密度為____g·cm-3(不必簡化)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com