
科目: 來源: 題型:
【題目】向NaOH溶液中緩慢通入![]() 氣體,溶液中
氣體,溶液中![]() 的物質的量與通入
的物質的量與通入![]() 的物質的量的關系如圖。下列說法錯誤的是
的物質的量的關系如圖。下列說法錯誤的是

A.水的電離程度:![]()
B.a、b兩點溶液的pH滿足:![]()
C.c點溶液滿足:![]()
D.a、b、c三點溶液都滿足:![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】酸性![]() 溶液與
溶液與![]() 溶液反應的離子方程式為:
溶液反應的離子方程式為:![]() ,某同學設計如下表所示方案探究溫度、濃度改變對該反應速率的影響情況。
,某同學設計如下表所示方案探究溫度、濃度改變對該反應速率的影響情況。
實驗序號 | 實驗溫度 | 參加反應的物質 | 溶液顏色褪至無色所需時間 | ||||
|
|
| |||||
|
|
|
|
| |||
A | 298 | 2 |
| 4 | a | 0 |
|
B |
| 2 |
| 3 | a |
| 10 |
C | 318 | 2 |
|
| a | 1 |
|
(1)實驗中a的最小值為____________,探究溫度變化對反應速率影響情況的兩組實驗是________。
(2)![]() ____________,
____________,![]() ____________,利用實驗B中數據計算,用
____________,利用實驗B中數據計算,用![]() 的濃度變化表示的反應速率為
的濃度變化表示的反應速率為![]() ________。
________。
(3)他們發現,A組實驗中收集的![]() 體積如圖a所示;若使A組反應在絕熱容器中進行,該反應的反應速率隨著時間的變化如圖b所示。
體積如圖a所示;若使A組反應在絕熱容器中進行,該反應的反應速率隨著時間的變化如圖b所示。
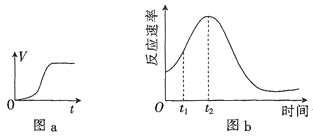
![]() 時間內速率變快的主要原因可能是:一是產物中
時間內速率變快的主要原因可能是:一是產物中![]() 是反應的催化劑;二是______________________________。
是反應的催化劑;二是______________________________。
![]() 由圖b信息知,催化劑的催化效果與其用量________
由圖b信息知,催化劑的催化效果與其用量________![]() 填“有關”“無關”或“無法確定”
填“有關”“無關”或“無法確定”![]() 。
。
查看答案和解析>>
科目: 來源: 題型:
【題目】某溫度時,在2 L密閉容器中,三種氣態物質X、Y、Z的物質的量(n)隨時間(t)變化的曲線如圖所示,由圖中數據分析可得:

(1)該反應的化學方程式為 。
(2)反應開始至2 min,用Y表示的平均反應速率為 ,X的轉化率為 。
(3)在密閉容器里,通入a mol A(g)和b mol B(g),發生反應A(g)+ B(g)= 2C(g),當改變下列條件時,會加快反應速率的是 (填序號)。
①降低溫度 ②保持容器的體積不變,充入氦氣
③加入催化劑 ④保持容器的體積不變,增加A(g)的物質的量
查看答案和解析>>
科目: 來源: 題型:
【題目】美國亞利桑那州大學和阿貢國家實驗室的科學家最近設計出生產氫氣的人造樹葉,原理為2H2O(g) ![]() 2H2(g)+O2(g)。有關該反應的說法錯誤的是( )
2H2(g)+O2(g)。有關該反應的說法錯誤的是( )
A.沒有人造樹葉和太陽能的作用該反應不能自發進行
B.該反應最終是將太陽能轉化為電能
C.該反應為充分利用太陽能開辟了廣闊前景
D.氫能是理想的綠色能源
查看答案和解析>>
科目: 來源: 題型:
【題目】298K時,二元弱酸H2X溶液中含X微粒的分布分數如圖所示。下列敘述正確的是

A. 溶液呈中性時: c(Na+)=2c(X2-)
B. Ka2(H2X)為10-7
C. NaHX溶液c( H+)< c(OH-)
D. 溶液pH由1開至2.6時主要存在的反應是: H2X +OH-=HX-+ H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】隨著我國對環境問題的重視,碳、氮及其化合物的研究備受關注。
已知:Ⅰ![]()
![]() ;
;
Ⅱ![]()
![]() ;
;
Ⅲ![]()
![]()
![]() .
.
請回答下列問題:
(1)![]() ________。
________。
(2)一定溫度下,向剛性容器中充入![]() 和足量
和足量![]() ,發生上述反應,部分物質的物質的量濃度隨時間的變化情況如圖所示。
,發生上述反應,部分物質的物質的量濃度隨時間的變化情況如圖所示。
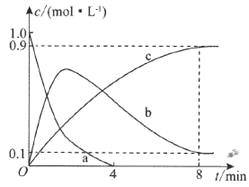
![]() 已知曲線a代表
已知曲線a代表![]() 的濃度變化,曲線b代表NO的濃度變化,則曲線c代表________的濃度變化。
的濃度變化,曲線b代表NO的濃度變化,則曲線c代表________的濃度變化。
![]() 該剛性容器的容積為________;
該剛性容器的容積為________;![]() 內,
內,![]() 的消耗速率
的消耗速率![]() ________。
________。
![]() 該條件下,反應Ⅰ和反應Ⅱ中活化能較大的是________
該條件下,反應Ⅰ和反應Ⅱ中活化能較大的是________![]() 填“反應Ⅰ”或“反應Ⅱ”
填“反應Ⅰ”或“反應Ⅱ”![]() ,原因為________。
,原因為________。
![]() 該溫度下,反應Ⅲ的化學平衡常數
該溫度下,反應Ⅲ的化學平衡常數![]() Ⅲ
Ⅲ![]() ________。
________。
(3)若其他條件不變,將恒溫容器改為絕熱容器,再次達到平衡后,與原平衡相比,CO的體積分數________![]() 填“增大”“減小”或“不變”
填“增大”“減小”或“不變”![]() ,原因為________。
,原因為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】“低碳經濟”備受關注,研究和深度開發![]() 的應用對構建生態文明社會具有重要的意義。
的應用對構建生態文明社會具有重要的意義。
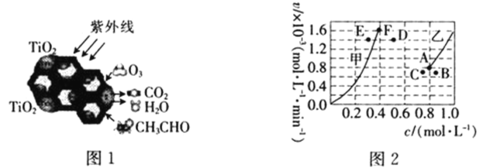
(1)![]() 是一種性能優良的光催化劑,能有效地將有機污染物轉化為
是一種性能優良的光催化劑,能有效地將有機污染物轉化為![]() 等小分子物質。圖1為在
等小分子物質。圖1為在![]() 的催化下,
的催化下,![]() 降解
降解![]() 的示意圖,則該反應的化學方程式為____________________________。
的示意圖,則該反應的化學方程式為____________________________。
(2)將一定量的![]() 和
和![]() 通入一恒容密閉容器中發生反應:
通入一恒容密閉容器中發生反應:![]() 。
。
![]() 化學鏈燃燒技術是目前能源領域研究的熱點之一,用NiO作載氧體的化學鏈燃燒的相關熱化學方程式如下:
化學鏈燃燒技術是目前能源領域研究的熱點之一,用NiO作載氧體的化學鏈燃燒的相關熱化學方程式如下:
![]()
![]()
則反應![]() 的
的![]() _______。
_______。
![]() 為了探究反應
為了探究反應![]() 的反應速率與濃度的關系,起始時向恒容密閉容器中通入
的反應速率與濃度的關系,起始時向恒容密閉容器中通入![]() 與
與![]() ,并使二者物質的量濃度均為
,并使二者物質的量濃度均為![]() ,平衡時,根據相關數據繪制出兩條反應速率與濃度關系曲線
,平衡時,根據相關數據繪制出兩條反應速率與濃度關系曲線![]() 如圖
如圖![]() :
:![]() 和
和![]() 。則與曲線
。則與曲線![]() 相對應的是圖中曲線________
相對應的是圖中曲線________![]() 填“甲”或“乙”
填“甲”或“乙”![]() ;該反應達到平衡后,某一時刻降低溫度,反應重新達到平衡,則此時曲線甲對應的平衡點可能為________
;該反應達到平衡后,某一時刻降低溫度,反應重新達到平衡,則此時曲線甲對應的平衡點可能為________![]() 填字母
填字母![]() 。
。
(3)用稀氨水噴霧捕集![]() 最終可得產品
最終可得產品![]() 。
。
![]() 在捕集時,氣相中有中間體
在捕集時,氣相中有中間體![]() 氨基甲酸銨
氨基甲酸銨![]() 生成。現將一定量純凈的氨基甲酸銨置于恒容密閉真空容器中,分別在不同溫度下進行反應:
生成。現將一定量純凈的氨基甲酸銨置于恒容密閉真空容器中,分別在不同溫度下進行反應:![]() 。實驗測得的有關數據如下表
。實驗測得的有關數據如下表![]() :
:
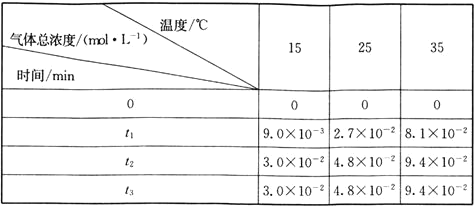
氨基甲酸銨的分解反應是________![]() 填“放熱”或“吸熱”
填“放熱”或“吸熱”![]() 反應。在
反應。在![]() ,此反應的化學平衡常數
,此反應的化學平衡常數![]() ________。
________。
![]() 在
在![]() 溶液中,反應
溶液中,反應![]() 的平衡常數
的平衡常數![]() 。已知常溫下
。已知常溫下![]() 的電離平衡常數
的電離平衡常數![]() ,則
,則![]() 的電離平衡常數
的電離平衡常數![]() ________。
________。
查看答案和解析>>
科目: 來源: 題型:
【題目】下圖是中學化學中常用于混合物的分離和提純的裝置,請根據裝置回答問題:
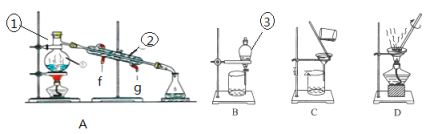
(1)寫出下列儀器的名稱:① __________②____________。
(2)儀器③中使用前必須檢查是否_________________。
(3)若利用裝置A分離乙酸(沸點118℃)和乙酸乙酯(沸點77.1℃)的混合物,還缺少的一種儀器名稱為__________。冷凝管中冷凝水應從____(填“f”或“g”)口進,在①中注入液體混合物后,加幾片碎瓷片的目的是_____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】重鉻酸鈉(Na2Cr2O7·2H2O)俗稱紅礬鈉,在工業方面有廣泛用途。我國目前主要是以鉻鐵礦(主要成份為FeO、Cr2O3,還含有Al2O3、MgO、SiO2等雜質)為主要原料進行生產,其主要工藝流程如下:
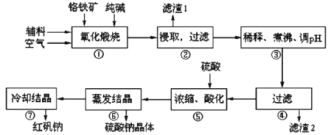
①中涉及的主要反應有:
主反應:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反應:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分陽離子以氫氧化物形式完全沉淀時溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀時溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
試回答下列問題:
(1)“①”中反應是在回轉窯中進行,反應時需不斷攪拌,其作用是________。
(2)“③”中調節pH至4.7,目的是________。
(3)“⑤”中加硫酸酸化的目的是使![]() 轉化為
轉化為![]() ,請寫出該平衡轉化的離子方程式:________。
,請寫出該平衡轉化的離子方程式:________。
(4)稱取重鉻酸鈉試樣2.5000g配成250mL溶液,取出25.00mL于碘量瓶(錐形瓶)中,加入10mL2mol·L-1H2SO4和足量碘化鈉(鉻的還原產物為Cr3+),放于暗處5min,然后加入100mL水,加入3mL淀粉指示劑,用0.1200mol·L-1Na2S2O3標準溶液滴定(I2+2![]() =2I-+
=2I-+![]() )。
)。
①判斷達到滴定終點的依據是:________;
②若實驗中共用去Na2S2O3標準溶液40.00mL,所得產品的中Na2Cr2O7的純度(設整個過程中其它雜質不參與反應)________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某校學生用中和滴定法測定某NaOH溶液的物質的量濃度,選甲基橙作指示劑。
(1)盛裝0.2000 mol/L鹽酸標準液應該用__式滴定管。
(2)滴定時,左手控制滴定管,右手搖動錐形瓶,眼睛注視__;終點判斷方法:_________________
(3)滴定操作可分解為如下幾步:
①檢查滴定管是否漏水;
②取一定體積的待測液于錐形瓶中;
③用標準溶液潤洗盛標準溶液的滴定管,用待測液潤洗盛待測液的滴定管
④裝標準溶液和待測液并調整液面(記錄初讀數)
⑤用蒸餾水洗滌玻璃儀器
⑥滴定操作
正確的操作順序為:_____
(4)有關數據記錄如下:
實驗序號 | 待測液體積(mL) | 所消耗鹽酸標準液的體積(mL) | |
滴定前 | 滴定后 | ||
1 | 20. 00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
則NaOH溶液的物質的量濃度為______mol/L(保留四位有效數字)
(5)若滴定時錐形瓶未干燥,則測定結果________;若滴定前平視讀數,滴定終點時仰視讀數,則會使所測堿的濃度值________。(填“無影響”、“偏高”或“偏低”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com