
科目: 來源: 題型:
【題目】一種以黃銅礦和硫磺為原料制取銅和其他產物的新工藝,原料的綜合利用率較高。其主要流程如下:

已知:“反應Ⅱ”的離子方程式為Cu2++CuS+4C1-==2[CuCl2]-+S
回答下列問題:
(1)鐵紅的化學式為__________________;
(2)“反應Ⅱ”的還原劑是_______________(填化學式);
(3)“反應III”的離子方程式為____________________________________;
(4)輝銅礦的主要成分是Cu2S,可由黃銅礦(主要成分CuFeS2)通過電化學反應轉變而成,有關轉化如下如圖 所示。轉化時正極的電極反應式為___________________。
(5)從輝銅礦中浸取銅元素,可用FeCl3作浸取劑。
①反應Cu2S+4FeCl32CuCl2+4FeCl2+S,每生成1mol CuCl2,反應中轉移電子的數目為______;浸取時,在有氧環境下可維持Fe3+較高濃度。有關反應的離子方程式是__________。
②浸取過程中加入洗滌劑溶解硫時,銅元素的浸取率的變化如圖,其原因是_______________。


(6)CuCl懸濁液中加入Na2S,發生的反應為2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq),該反應的平衡常數K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
Cu2S(s)+2Cl-(aq),該反應的平衡常數K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
查看答案和解析>>
科目: 來源: 題型:
【題目】鉬(Mo)是一種過渡金屬元素,它具有強度高、熔點高、耐腐蝕等優點,被廣泛應用于鋼鐵、石油、化工、電氣等領域。鉬酸鈉晶體(Na2MoO42H2O)是一種新型水處理劑。某化學興趣小組利用廢鉬催化劑(主要成分為MoS2,含少量Cu2S、FeS2)回收Mo并制備鉬酸鈉晶體,其主要流程如圖所示:
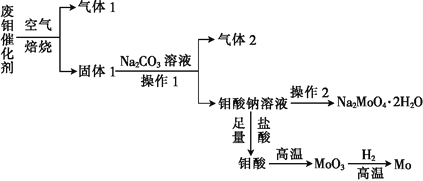
回答下列問題:
(1)可以提高焙燒效率的措施有__________________(填一條即可)。MoS2中的鉬元素在空氣中焙燒,很容易被氧化成MoO3,若生成0.1molMoO3,則反應中轉移電子的數目為______。
(2)往固體1中加碳酸鈉溶液,發生反應的化學方程式為_______________。
(3)操作2為______________、洗滌、干燥。
(4)制備鉬酸鈉晶體還可通過向精制的MoS2中直接加入次氯酸鈉溶液與氫氧化鈉溶液進行氧化的方法,若氧化過程中還有硫酸鈉生成,則反應的離子方程式為___________。
(5)已知鉬酸鈉溶液中c(MoO42-)=0.40mol/L,由鉬酸鈉溶液制備鉬酸鈉晶體時,需加入Ba(OH)2固體以除去CO32-,當BaMoO4開始沉淀時,溶液中c(CO32-)=_________[已知:Ksp(BaCO3)=2.6×10-9,Ksp(Ba MoO4)=4.0×10-8。忽略溶液的體積變化]。
(6)鋰和二硫化鉬形成的二次電池的總反應為xLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n附著在電極上],則電池充電時陽極的電極反應式為____。
Lix(MoS2)n[Lix(MoS2)n附著在電極上],則電池充電時陽極的電極反應式為____。
查看答案和解析>>
科目: 來源: 題型:
【題目】工業上利用軟錳礦(主要成分為MnO2,同時含少量鐵、鋁等的化合物)制備硫酸錳的常見流程如下:
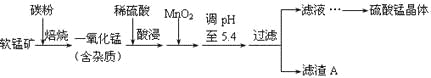
部分金屬陽離子以氫氧化物形式完全沉淀時溶液的pH見下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化錳用硫酸酸浸時發生的主要反應的離子方程式為____________________。酸浸后加入MnO2將溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)濾渣A的成分除MnO2外,還有_______________。
(3)MnO2是制造堿性鋅錳電池的基本原料,放電時負極的電極反應式為________。工業上以石墨為電極電解酸化的MnSO4溶液生產MnO2,陽極的電極反應式為_________,當陰極產生4.48L(標況)氣體時,MnO2的理論產量為______g。
(4)錳的三種難溶化合物的溶度積:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,則上述三種難溶物的飽和溶液中,Mn2+濃度由大到小的順序是_______>_______>_______(填寫化學式)。
查看答案和解析>>
科目: 來源: 題型:
【題目】粗銅精煉后的陽極泥中含有Cu、Au(金)和PbSO4等雜質,濕法處理陽極泥進行綜合利用的工藝流程如圖所示:
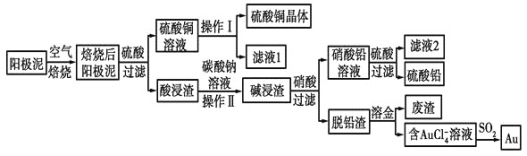
(1)電解精煉含銅、金、鉛的粗銅時,電解液應該用________溶液作電解液,電解時陽極的電極反應式為___________________________和Cu-2e-=Cu2+。
(2)完成操作Ⅰ的主要步驟有:__________________,過濾,洗滌,干燥。
(3)寫出用SO2還原AuCl4-的離子反應方程式____________________________。
(4)為了減少廢液排放、充分利用有用資源,工業上將濾液1并入硫酸銅溶液進行循環操作,請指出流程圖中另一處類似的做法________________________。
(5)用離子方程式表示加入碳酸鈉溶液的作用:___________________________。[已知298K時,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)=1.82×10-8]。當溶液中c(SO42-)=0.2mol/L時,c(CO32-)=________mol/L。![]() 結果保留2位有效數字
結果保留2位有效數字![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】在t℃時,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,則在該溫度下,將100 mL 0.10 mol/L的稀硫酸與100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH為(已知:忽略混合時體積的變化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目: 來源: 題型:
【題目】高錳酸鉀是錳的重要化合物和常用的氧化劑。以下是工業上用軟錳礦制備高錳酸鉀的一種工藝流程:
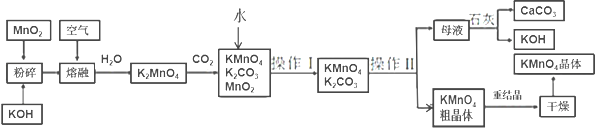
(1)KMnO4稀溶液是一種常用的消毒劑。其消毒原理與下列________________物質相似。
a.75%酒精 b.雙氧水 c.苯酚 d.“84”消毒液(NaClO溶液)
(2)粉碎的目的是________________,操作Ⅰ的名稱是________________
(3)上述流程中可以循環使用的物質有石灰、CO2、_________和__________(寫化學式)。
(4)向K2MnO4溶液中通入CO2以制備KMnO4,該反應中的還原劑是____________。
(5)鉍酸鈉(NaBiO3,不溶于水)用于定性檢驗酸性溶液中Mn2+的存在(鉍元素的還原產物為Bi3+,Mn的氧化產物為+7價),寫出反應的離子方程式:__________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】二氧化氯(ClO2)是一種黃綠色氣體,易溶于水,在混合氣體中的體積分數大于10%就可能發生爆炸,在工業上常用作水處理劑、漂白劑。回答下列問題:
(1)某小組設計了如下圖所示的實驗裝置用于制備ClO2。
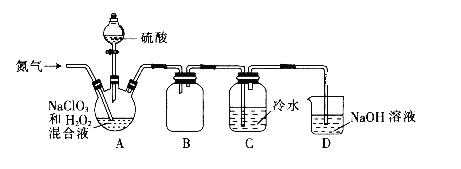
①通入氮氣的主要作用有2個,一是可以起到攪拌作用,二是__________。
②裝置B的作用是_________。
③當看到裝置C中導管液面上升時應進行的操作是________。
(2)用0.1000mol·L-1的Na2S2O3標準液測定裝置C中ClO2溶液的濃度。原理:2ClO2+10I-+8H+=5I2+2Cl-+4H2O , I2+2S2O32- = 2I- +S4O62-
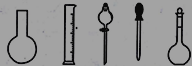
①配制0.1000molL-1的Na2S2O3標準溶液時所需儀器除在如圖所示的儀器中進行選擇外,還需用到的玻璃儀器是________(填儀器名稱)
②在實驗中其他操作均正確,若定容時仰視刻度線,則所得溶液濃度___0.1000molL-1(填“>”、“<”或“=”,下同);若Na2S2O3標準溶液在轉移至容量瓶時,灑落了少許,則所得溶液濃度___0.1000molL-1。
③取10mLC中溶液于錐形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___________作指示劑,測得標準液消耗的體積為20.00mL,通過計算可知C中ClO2溶液的濃度為________ mol·L-1。
查看答案和解析>>
科目: 來源: 題型:
【題目】鋰—銅空氣燃料電池(如圖)容量高、成本低,該電池通過一種復雜的銅腐蝕“現象”產生電力,其中放電過程為:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列說法錯誤的是( )

A. 放電時,當電路中通過0.1 mol電子的電量時,有0.1molLi+透過固體電解質向Cu極移動,有標準狀況下1.12L氧氣參與反應
B. 整個反應過程中,氧化劑為O2
C. 放電時,正極的電極反應式為:Cu2O+H2O+2e-=2Cu+2OH-
D. 通空氣時,銅被腐蝕,表面產生Cu2O
查看答案和解析>>
科目: 來源: 題型:
【題目】25℃時,下列有關電解質溶液中微粒的物質的量濃度關系不正確的是
A.等濃度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(![]() ):①>③>②
):①>③>②
B.等體積pH=a的醋酸與pH=b的NaOH溶液(a+b=14)充分混合時,可能有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.已知Ka(HClO)=3.0×10-8,Ka(HCN)=6.2×10-10,等體積、等濃度的NaClO、NaCN溶液中,前者中的離子總數小于后者中的離子總數
D.向20mL氨水中加入10mL等濃度的鹽酸,有c(![]() )-c(NH3H2O)=2[c(OH-)-c(H+)]
)-c(NH3H2O)=2[c(OH-)-c(H+)]
查看答案和解析>>
科目: 來源: 題型:
【題目】工業上用軟錳礦(主要成分為MnO2,含有少量的SiO2和FeS2雜質)為原料制取高純MnO2,其工藝流程如下:

回答下列問題:
(1)步驟①將軟錳礦研磨成細粉的主要目的是________;步驟②酸浸取時,主要產物有S、MnSO4及Fe2(SO4)3,寫出反應的化學方程式:________。
(2)濾渣Ⅰ的主要成分是________。
(3)步驟④加入氨水調節pH=4,過濾后的濾液中,c(Fe3+)=________mol/L。{已知Ksp[Fe(OH)3]=1×10-38}
(4)步驟⑤所得的濾渣Ⅱ可用于制備鐵紅,該反應的化學方程式為________。

(5)步驟⑥電解MnSO4酸性溶液,原理如圖所示。陽極產生MnO2,其電極反應式為________;陰極產生的氣體為________(寫化學式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com