
科目: 來源: 題型:
【題目】常溫下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,圖中所示曲線表示混合溶液的pH變化情況(體積變化忽略不計)。回答下列問題:
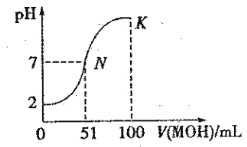
(1)由圖中信息可知HA為 酸(填“強”或“弱”),理由是 。
(2)常溫下一定濃度的MA稀溶液的pH = a,則a_________7(填“ > ”、“< ”或“=”),用離子方程式表示其原因:_____________________,此時,溶液中由水電離出的c(OH-)= 。
(3)請寫出K點所對應的溶液中離子濃度的大小關系:____________________。
(4)K點對應的溶液中,c(M+) +c(MOH)__________2c (A-)(填“>”“<”或“=”);若此時溶液的 pH = 10,則 c(MOH) +c(OH-) =_____________mol· L-1。
查看答案和解析>>
科目: 來源: 題型:
【題目】A、B、C是與植物生命活動密切相關的三種常見化合物,每種物質所含元素種類均不超過三種,甲是單質,有機物D也是生活中常見的物質,在一定條件下可發生如下反應:![]() 。它們之間有如圖所示的轉化關系:
。它們之間有如圖所示的轉化關系:
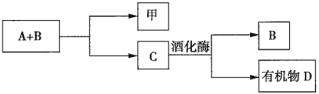
(1)在化合物A、B、C、D中所含元素種類完全相同的是________(填序號,下同)和________。
(2)在常溫下,A和B通過________轉化為C。該過程中________能轉化為________能。
(3)寫出由C生成D的化學方程式:________________。
(4)目前化合物B在大氣中的含量呈上升趨勢,其對環境造成的影響是________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室以V2O5為原料制備氧釩(Ⅳ)堿式碳酸銨晶體{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O},其流程如下:
V2O5![]() VOCl2溶液
VOCl2溶液![]() 氧釩(Ⅳ)堿式碳酸銨晶體
氧釩(Ⅳ)堿式碳酸銨晶體
(1)“還原”過程中的還原劑是____________(填化學式)。
(2)已知VO2+能被O2氧化,“轉化”可在如圖裝置中進行。
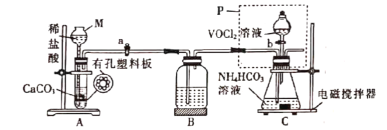
①儀器M的名稱是___________,實驗開始前的操作是_________。
②裝置B的作用是__________________。
③得到紫紅色晶體,抽濾,并用飽和NH4HCO3溶液洗滌3次,用無水乙醇洗滌2次,再用乙醚洗滌2次,抽干稱重。用無水乙醇洗滌的目的是_______________。
④稱量mg產品于錐形瓶中,用20mL蒸餾水與30mL稀硫酸溶解后,加入0.02mol/LKMnO4溶液至稍過量,充分反應后繼續滴加1%的NaNO2溶液至稍過量,再用尿素除去過量NaNO2,最后用cmol/L(NH4)2Fe(SO4)2標準溶液滴定至終點(已知滴定反應為VO2++Fe2++2H+=VO2++Fe3++H2O),消耗標準溶液的體積為VmL。若(NH4)2Fe(SO4)2標準溶液部分變質,會使測定結果______________(填“偏高”、“偏低”或“無影響”),產品中釩的質量分數為_________(以VO2+的量進行計算,列出計算式)。
查看答案和解析>>
科目: 來源: 題型:
【題目】成熟的蘋果中含有淀粉、葡萄糖和無機鹽等,某課外興趣小組設計了一組實驗證明某些成分的存在,請你參與并協助他們完成相關實驗。
(1)用小試管取少量的蘋果汁,加入_______(填名稱),溶液變藍,則證明蘋果中含有淀粉。
(2)利用含淀粉的物質可以生產醋酸。下面是生產醋酸的流程圖,試回答下列問題:
![]()
B是日常生活中有特殊香味的常見有機物,在有些飲料中含有B。
①寫出化學方程式,并注明反應類型。
B與醋酸反應:____________________________,屬于______________反應。
B→C____________________________,屬于____________________________反應。
②可用于檢驗A的試劑是____________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】新型鈣鈦礦型太陽能電池以其穩定、高效、便宜和便于制造等優點被科學家所青睞。這種鈣鈦礦型太陽能電池材料為層狀結構。具體如圖1所示。

(1)基態Ti原子的電子排布式為____;同周期的基態原子與其未成對電子數相同的元素還有________種。
(2)光敏鈣鈦礦的晶胞結構如圖2所示。
①寫出與CH3NH3+互為等電子體的一種分子的化學式:__,C、N、O三種元素的第一電離能由大到小的順序為____(用元素符號表示),CH3NH3+中含有的化學鍵類型有____。
②光敏鈣鈦礦的化學式為________;每個CH3NH3+周圍最近且等距離的Br-數目為__。
③若該光敏鈣鈦礦的摩爾質量為M g·mol-1,晶胞參數為anm,阿伏加德羅常數的值為NA,則該晶體的密度為____ g.cm-3(用含M、a、NA的代數式表示)。
(3)石墨炔的結構如圖3所示,其中碳原子的軌道雜化類型是 _____ ,36 g石墨炔中含有σ鍵的數目為____。
查看答案和解析>>
科目: 來源: 題型:
【題目】合理利用和轉化NO2、SO2、CO、NO等污染性氣體是環保領域的重要課題。
(1)用CH4催化還原氮氧化物可以消除氮氧化物污染。已知:
①![]() ;
;![]() ;
;
②![]() ,
,![]() ;
;
③![]() ,
,![]() ;
;
1 mol CH4(g)與NO2(g)反應生成N2(g)、CO2(g)和H2O(1)的反應熱為________。
(2)已知![]() 的反應歷程分兩步:
的反應歷程分兩步:
①![]() (快);
(快);![]() ,
,![]() ;
;
②![]() (慢);
(慢);![]() ,
,![]()
一定溫度下,反應![]() 達到平衡狀態,該反應的平衡常數的表達式K=____(用
達到平衡狀態,該反應的平衡常數的表達式K=____(用![]() 表示),反應①的活化能E1與反應②的活化能E2的大小關系為E1____E2(填“>”“<”或“=”)。
表示),反應①的活化能E1與反應②的活化能E2的大小關系為E1____E2(填“>”“<”或“=”)。
(3)用活性炭還原法處理氮氧化物的有關反應為:![]() 。向恒容密閉容器中加入一定量的活性炭和NO,恒溫(T℃)時,各物質的濃度隨時間的變化如下表:
。向恒容密閉容器中加入一定量的活性炭和NO,恒溫(T℃)時,各物質的濃度隨時間的變化如下表:
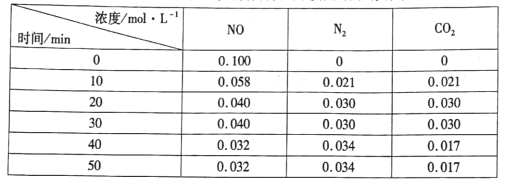
①T℃時,該反應的平衡常數的計算式為______。
②在31 min時,若只改變某一條件使平衡發生移動,40 min、50 min時各物質的濃度如上表所示,則改變的條件是____
③在51 min時,保持溫度和容器體積不變再充人NO和N2,使二者的濃度均增加至原來的兩倍,此時反應v正____v逆(填“>”、“<”或“=”)。
(4)反應N2O4(g) ![]() 2NO2(g) △H>0,在一定條件下N2O4與NO2的消耗速率與各自的分壓(分壓=總壓×物質的量分數)有如下關系:
2NO2(g) △H>0,在一定條件下N2O4與NO2的消耗速率與各自的分壓(分壓=總壓×物質的量分數)有如下關系:![]() ,其中k1、k2是與溫度有關的常數,相應的速率與N2O4或NO2的分壓關系如圖所示。
,其中k1、k2是與溫度有關的常數,相應的速率與N2O4或NO2的分壓關系如圖所示。
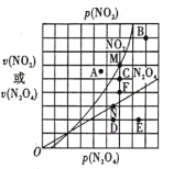
在T℃時,圖中M、N點能表示該反應達到平衡狀態,理由是___________ 。改變溫度,v(NO2)會由M點變為A、B或C,v(N2O4)會由N點變為D、E或F,當升高到某一溫度時,反應重新達到平衡,相應的點分別為_______(填字母)。
查看答案和解析>>
科目: 來源: 題型:
【題目】雄黃(As4S4)和雌黃(As2S3)是提取砷的主要礦物原料,二者在自然界中共生。
根據題意完成下列填空:
(1)As2S3和SnCl2在鹽酸中反應轉化為As4S4和SnCl4并放出H2S氣體。若As2S3和SnCl2正好完全反應,As2S3和SnCl2的物質的量之比為_______。
(2)上述反應中的氧化劑是_______,反應產生的氣體可用_______吸收。
(3)As2S3和HNO3有如下反應:As2S3 + 10H++ 10NO3-→2H3AsO4 + 3S+ 10NO2↑+ 2H2O
若生成2mol H3AsO4,則反應中轉移電子的物質的量為_______。若將該反應設計成原電池,則NO2應該在____(填“正極”或“負極”)附近逸出。
(4)若反應產物NO2與11.2L O2(標準狀況)混合后用水吸收全部轉化成濃HNO3,然后與過量的碳反應,所產生的CO2的量____(選填編號)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5 mol d.無法確定
查看答案和解析>>
科目: 來源: 題型:
【題目】某二元酸(化學式用H2B表示)在水中的電離方程式是H2B=H++HB-;HB-![]() H++B2-。回答下列問題。
H++B2-。回答下列問題。
(1)Na2B溶液顯________(填“酸性”“中性”或“堿性”),理由是____________________(用離子方程式表示)。
(2)在0.1mol·L-1的Na2B溶液中,下列粒子濃度關系式正確的是________(填字母)。
A.c(B2-)+c(HB-)+c(H2B)=0.1mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1mol·L-1NaHB溶液的pH=2,0.1mol·L-1NaHB溶液中各種離子濃度由大到小的順序是______________________________
查看答案和解析>>
科目: 來源: 題型:
【題目】亞砷酸(H3AsO3)可以用于治療白血病,在溶液中存在多種微粒形態。向1L0.1mol·L-1H3AsO3溶液中逐滴加入KOH溶液,各種微粒物質的量分數與溶液的pH 關系如下圖所示。下列說法正確的是( )
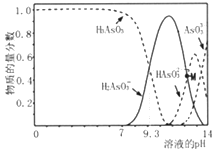
A. H3AsO3的電離常數Ka1的數量級為10-9
B. pH在8.0~10.0時,反應的離子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M點對應的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12時,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目: 來源: 題型:
【題目】我國科學家以MoS2為催化劑,在不同電解質溶液中實現常溫電催化合成氨,其反應歷程與相對能量模擬計算結果如圖。下列說法錯誤的是( )

A. Li2SO4溶液利于MoS2對N2的活化
B. 兩種電解質溶液環境下從N2→NH3的焓變不同
C. MoS2(Li2SO4溶液)將反應決速步(*N2→*N2H)的能量降低
D. N2的活化是N≡N鍵的斷裂與N—H鍵形成的過程
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com