
科目: 來源: 題型:
【題目】以淀粉為基本原料制備聚乙烯和乙酸。下列說法正確的是( )
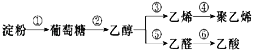
A.淀粉和葡萄糖都是營養物質,均能在體內發生水解、氧化反應
B.工業上以石油為原料制取聚乙烯,需經裂解、加聚等反應
C.燃燒等物質的量的乙烯和乙醇耗氧量不同
D.乙醇和乙酸發生酯化反應制乙酸乙酯,原子利用率為100%
查看答案和解析>>
科目: 來源: 題型:
【題目】元素鉻(Cr)在自然界主要以+3價和+6價存在。請回答下列問題:
(1)+6價的Cr能引起細胞的突變而對人體不利,可用 Na2SO3 將Cr2O72—還原為Cr3+。該反應的離子反應方程式為___________。
(2)利用鉻鐵礦(FeOCr2O3)冶煉制取金屬鉻的工藝流程如圖所示:

①為加快焙燒速率和提高原料的利用率,可采取的措施之一是__________________________ 。
②“水浸”要獲得浸出液的操作是_________________________________。浸出液的主要成分為Na2CrO4,向“濾液”中加入酸化的氯化鋇溶液有白色沉淀生成,則 “還原”操作中發生反應的離子方程式為___。
③加熱Cr(OH)3可得到Cr2O3,從工業成本角度考慮,用Cr2O3制取金屬Cr的冶煉方法是 _______。
(3)已知 Cr3+完全沉淀時溶液pH為5,(Cr3+濃度降至10-5molL-1可認為完全沉淀)則Cr(OH)3的溶度積常數 Ksp=_______________。
(4)用石墨電極電解鉻酸鈉(Na2CrO4)溶液,可制重鉻酸鈉(Na2Cr2O7),實驗裝置如圖所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() + H2O)。
+ H2O)。
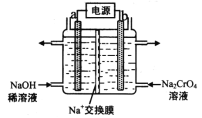
①電極b連接電源的______極(填“正”或“負”) , b 極發生的電極反應式為_________________。
②電解一段時間后,測得陽極區溶液中Na+物質的量由a mol變為b mol,則理論上生成重鉻酸鈉的物質的量是 _______________mol 。
查看答案和解析>>
科目: 來源: 題型:
【題目】在2L的密閉容器中,發生以下反應:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒鐘A的平均反應速度為0.12 mol/(L·s),則10秒鐘時,容器中B的物質的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒鐘A的平均反應速度為0.12 mol/(L·s),則10秒鐘時,容器中B的物質的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目: 來源: 題型:
【題目】下列實驗問題處理方法正確的是( )
①用pH試紙測溶液pH時,將試紙用水潤濕再蘸取待測液
②實驗結束后,可將所有的廢液倒入下水道排出實驗室
③給試管中的液體加熱時加入碎瓷片,以免暴沸傷人
④測定硫酸銅結晶水含量時,將晶體加熱至白色,然后冷卻、稱重即可計算
⑤配制稀硫酸時,先在燒杯中加一定體積的水,再邊攪拌邊加入濃硫酸
A.①②B.③④⑤C.①③⑤D.③⑤
查看答案和解析>>
科目: 來源: 題型:
【題目】用![]() 表示阿伏加德羅常數的值,下列說法正確的是
表示阿伏加德羅常數的值,下列說法正確的是![]()
![]()
A.標準狀況下![]() 和
和![]() 混合氣體中所含氮原子數為
混合氣體中所含氮原子數為![]()
B.常溫常壓下,![]() 重水中含有的中子數為
重水中含有的中子數為![]()
C.標準狀況下![]() 與Fe充分反應轉移電子數為
與Fe充分反應轉移電子數為![]()
D.在![]() 醋酸鈉溶液中陰離總數等于
醋酸鈉溶液中陰離總數等于![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】下列各選項有機物同分異構體的數目,與分子式為ClC4H7O2,且能與碳酸氫鈉反應生成氣體的有機物數目相同的是(不含立體異構)( )
A. 分子式為C5H10的烯烴B. 分子式為C4H8O2的酯
C. ![]() 的一溴代物D. 立方烷(
的一溴代物D. 立方烷( )的二氯代物
)的二氯代物
查看答案和解析>>
科目: 來源: 題型:
【題目】在密閉容器中有反應mA(g)+nB(g) ![]() pC(g) (正反應吸熱)處于平衡狀態,已知m + n > p,則下列說法正確的是 ( )
pC(g) (正反應吸熱)處于平衡狀態,已知m + n > p,則下列說法正確的是 ( )
①升溫時c(B)/ c(C)比值減小 ②充入C,則A、B的物質的量增大 ③充入B,則A的轉化率變大④加入催化劑,氣體的總物質的量不變
A.①②B.②③C.③④D.①②③④
查看答案和解析>>
科目: 來源: 題型:
【題目】下列實驗操作或處理事故的方法正確的是( )
A.用干燥的pH試紙測定NaClO溶液的pH
B.在耐高溫的石英坩堝中進行熔化氫氧化鈉固體的實驗
C.用分液漏斗分離乙酸乙酯和水的混合物時,水從下口放出,乙酸乙酯從上口倒出
D.欲配制質量分數為10%的硫酸銅溶液,可準確稱取10 g硫酸銅晶體溶于90 g水中
查看答案和解析>>
科目: 來源: 題型:
【題目】下列關于有機物1-氧雜-2,4-環戊二烯(![]() )的說法正確的是
)的說法正確的是
A. 與![]() 互為同系物B. 二氯代物有3種
互為同系物B. 二氯代物有3種
C. 所有原子都處于同一平面內D. 1mol該有機物完全燃燒消耗5molO2
查看答案和解析>>
科目: 來源: 題型:
【題目】放熱反應CO(g)+H2O(g)![]() CO2(g)+H2(g)在溫度t1時達到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常數為K1。其他條件不變,升高反應體系的溫度至t2時,反應物的平衡濃度分別為c2(CO)和c2(H2O),平衡常數為K2,則
CO2(g)+H2(g)在溫度t1時達到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常數為K1。其他條件不變,升高反應體系的溫度至t2時,反應物的平衡濃度分別為c2(CO)和c2(H2O),平衡常數為K2,則
A.若增大CO的濃度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(H2O) D. c1(CO)>c2(CO)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com