
科目: 來源: 題型:
【題目】氨對人類的生產生活具有重要影響。
(1)氨的制備與利用。
① 工業合成氨的化學方程式是_______________________________。
② 氨催化氧化生成一氧化氮反應的化學方程式是_____________________________。
(2)氨的定量檢測。
水體中氨氣和銨根離子(統稱氨氮)總量的檢測備受關注。利用氨氣傳感器檢測水體中氨氮含量的示意圖如下:

① 利用平衡原理分析含氨氮水樣中加入NaOH溶液的作用:_____________________。
② 若利用氨氣傳感器將1 L水樣中的氨氮完全轉化為N2時,轉移電子的物質的量為6×10-4 mol ,則水樣中氨氮(以氨氣計)含量為_______mg·L-1。
(3)氨的轉化與去除。
微生物燃料電池(MFC)是一種現代化氨氮去除技術。下圖為MFC碳氮聯合同時去除的氮轉化系統原理示意圖。
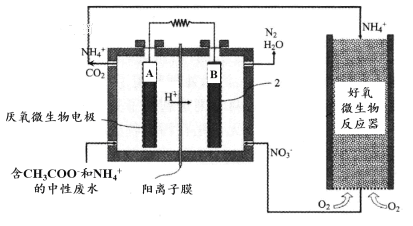
① 已知A、B兩極生成CO2和N2,寫出A極的電極反應式:______________________。
② 用化學用語簡述NH4+去除的原理:_________________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】CoCl2·6H2O是一種飼料營養強化劑。一種利用水鈷礦(主要成分為Co2O3、Co(OH)3,還含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工藝流程如下:

已知:①浸出液中含有的陽離子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:(金屬離子濃度為:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔點為86℃,加熱至110~120℃時,失去結晶水生成無水氯化鈷。
(1)寫出浸出過程中Co2O3發生反應的離子方程式______________。
(2)寫出NaClO3發生反應的主要離子方程式______________;若不慎向“浸出液”中加過量NaClO3時,可能會生成有毒氣體,寫出生成該有毒氣體的離子方程式_____________。
(3)“加Na2CO3調pH至a”,過濾所得到的兩種沉淀的化學式為___________。
(4)制得的CoCl2·6H2O在烘干時需減壓烘干的原因是__________________。
(5)萃取劑對金屬離子的萃取率與pH的關系如圖。向“濾液”中加入萃取劑的目的是_________;其使用的最佳pH范圍是________________。
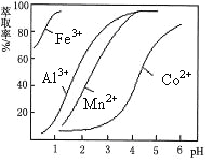
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)為測定粗產品中CoCl2·6H2O含量,稱取一定質量的粗產品溶于水,加入足量AgNO3溶液,過濾、洗滌,將沉淀烘干后稱其質量。通過計算發現粗產品中CoCl2·6H2O的質量分數大于100%,其原因可能是________________。(答一條即可)
查看答案和解析>>
科目: 來源: 題型:
【題目】某同學設計實驗探究構成原電池的條件,裝置如圖所示:
甲.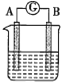 乙.
乙.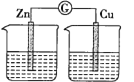
實驗一:探究電極的構成。圖甲中,①A、B兩極均選用石墨作電極,發現電流計指針不偏轉;②A、B兩極均選用銅片作電極,發現電流計指針不偏轉;③A極用鋅片,B極用銅片,發現電流計指針向左偏轉;④A極用鋅片,B極用石墨,發現電流計指針向左偏轉。
(1)結論一:________________________;
實驗二:探究溶液的構成。圖甲中,A極用鋅片,B極用銅片,①液體采用無水乙醇,發現電流計指針不偏轉;②改用硫酸溶液,發現電流計指針偏轉,B極上有氣體產生。
(2)結論二:________________________;
實驗三:探究圖乙裝置能否構成原電池。將鋅、銅兩電極分別放入稀硫酸中,發現鋅片上有氣泡產生,銅片上無明顯現象,電流計指針不發生偏轉。
(3)結論三:________________________;
思考:對該同學的實驗,有同學提出了如下疑問,請你幫助解決。
(4)在圖甲裝置中,若A為鎂片,B為鋁片,電解質溶液為![]() 溶液;負極為________(填“A”或“B”);電流計的指針應向________(填“右”或“左”)偏轉。
溶液;負極為________(填“A”或“B”);電流計的指針應向________(填“右”或“左”)偏轉。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1,
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有關說法正確的是( )
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有關說法正確的是( )
A. 向含0.1molNaOH的溶液中加入一定體積的0.1mol·L-1乙二酸,反應中的能量變化如圖所示
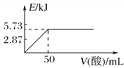
B. H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
C. 氫氣的標準燃燒熱為241.8 kJ·mol-1
D. 若反應②中水為液態,則同樣條件下的反應熱:ΔH>ΔH2
查看答案和解析>>
科目: 來源: 題型:
【題目】碳、氮元素及其化合物與生產、生活密切相關,回答下列問題。
(1)某有機物的結構簡式如圖。該有機物分子是___(填“極性”或“非極性”)分子,該有機物分子中電負性最大的原子為___。
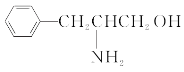
(2)乙二胺(H2NCH2CH2NH2)分子中氮原子雜化類型為___,乙二胺和三甲胺[N(CH3)3]均屬于胺,但乙二胺比三甲胺的沸點高很多,原因是__。
查看答案和解析>>
科目: 來源: 題型:
【題目】用NA表示阿伏加德羅常數的數值,下列敘述中不正確的是( )
A.16g氧氣中含有的氧原子數目為NA
B.1L0.1mol·L-1Na2CO3溶液中含有的陰離子數目大于0.1NA
C.標準狀況下,22.4LCl2中含有的電子數為34NA
D.標準狀況下,22.4L乙醇中含有的分子數為NA
查看答案和解析>>
科目: 來源: 題型:
【題目】25℃時,用0.25mol·L-1的NaOH溶液,分別滴定同濃度的三種稀酸溶液,滴定的曲線如圖所示,下列判斷不正確的是
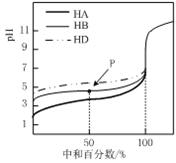
A. 同濃度的稀酸中:c(A-)>c(B-)>c(D-)
B. 滴定至P點時,溶液中:c(B-)>c(HB)
C. pH=7時,三種溶液中:c(A-)>c(B-)>c(D-)
D. 當中和百分數達100%時,將三種溶液混合后:c(HA)+c(HB) +c(HD)═c(OH-)-2c(H+)
查看答案和解析>>
科目: 來源: 題型:
【題目】有a、b、c、d四個金屬電極,有關的實驗裝置及部分實驗現象如下:
實驗裝置 |
|
|
部分實驗現象 | a極質量減小b極質量增加 | b極有氣泡產生c極無變化 |
實驗裝置 |
|
|
部分實驗現象 | d極溶解c極有氣泡產生 | 電流從a極流向d極 |
由此判斷這四種金屬的活動性順序是( )
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c
查看答案和解析>>
科目: 來源: 題型:
【題目】鉍及其化合物在工業生產中用途廣泛,某研究小組用浮選過的輝鉍礦(主要成分是Bi2S3,還含少量Bi2O3、SiO2等雜質)制備鉍酸鈉,其流程如下:
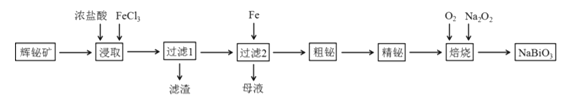
已知:①鉍酸鈉是一種難溶于水的物質;②水解能力:Bi3+>Fe3+。
回答下列問題:(1)“浸取”時,為了提高浸取速率,可采取的措施有______(任寫一條);過濾1的濾渣中的某種主要成分可溶于一種弱酸,寫出該反應的化學方程式______。
(2)浸取時加入過量濃鹽酸的目的是______;“母液”中通入氣體X后可循環利用,氣體X為______(填名稱)。
(3)寫出焙燒時生成鉍酸鈉的化學方程式______。
(4)用![]() 雙硫腙,二元弱酸
雙硫腙,二元弱酸![]() 絡合萃取法可從工業廢水中提取金屬離子:
絡合萃取法可從工業廢水中提取金屬離子:![]() 先將金屬離子絡合成電中性的物質
先將金屬離子絡合成電中性的物質![]() 如
如![]() 等
等![]() ,再用
,再用![]() 萃取此絡合物。圖2是用上述方法處理含有
萃取此絡合物。圖2是用上述方法處理含有![]() 、
、![]() 、
、![]() 的廢水時的酸度曲線(E%表示金屬離子以絡合物形式被萃取分離的百分率)。
的廢水時的酸度曲線(E%表示金屬離子以絡合物形式被萃取分離的百分率)。
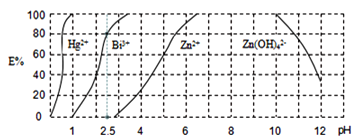
①當![]() :
:![]() :4時,廢水的
:4時,廢水的![]() ______。
______。
②向萃取后的![]() 中加入足量的NaOH溶液可將鉍元素以氫氧化物的形式沉淀下來,相應的離子方程式為___。
中加入足量的NaOH溶液可將鉍元素以氫氧化物的形式沉淀下來,相應的離子方程式為___。
(5)取焙燒得到的![]() 樣品
樣品![]() ,加入稀硫酸和
,加入稀硫酸和![]() 溶液使其完全溶解。已知
溶液使其完全溶解。已知![]() 被還原為
被還原為![]() ,
,![]() 被氧化成成
被氧化成成![]() ,試寫出該反應的離子方程式:____。然后用新配制的
,試寫出該反應的離子方程式:____。然后用新配制的![]() 溶液對生成的
溶液對生成的![]() 進行滴定,滴定完成后稍耗
進行滴定,滴定完成后稍耗![]() 溶液。則該樣品中
溶液。則該樣品中![]() 純度為____。
純度為____。
查看答案和解析>>
科目: 來源: 題型:
【題目】用如圖所示裝置進行實驗:
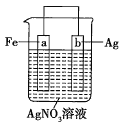
若圖中x軸表示流入正極的電子的物質的量,則y軸可以表示:①![]() ,②
,②![]() ,③a棒的質量,④b棒的質量,⑤溶液的質量中的( )
,③a棒的質量,④b棒的質量,⑤溶液的質量中的( )
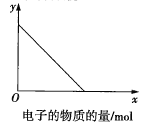
A.①③B.②④C.①③⑤D.②④⑤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com