
科目: 來源: 題型:
【題目】某同學想通過實驗探究硫和碳得電子能力的強弱,通過比較它們最高價氧化物對應水化物的酸性強弱來驗證,設計了如圖實驗。
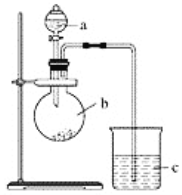
(1)儀器a的名稱是________,應盛放下列藥品中的________(填字母)。
A.稀硫酸 B.亞硫酸C.氫硫酸 D.鹽酸
(2)儀器b的名稱是________,應盛放下列藥品中的________(填字母)。
A.碳酸鈣 B.硫酸鈉 C.氯化鈉 D.碳酸鈉
(3)儀器c中應盛放的試劑是________,如果看到的現象是____________________,證明b中反應產生了________,即可證明________比________酸性強,得電子能力________比________強,b中發生反應的離子方程式為______________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】用0.100 0molL﹣1 NaOH溶液滴定20.00mL未知濃度的鹽酸(酚酞作指示劑)的滴定曲線如圖所示.下列說法正確的是( )

A.水電離出的氫離子濃度:a>b
B.鹽酸的物質的量濃度為0.0100 molL﹣1
C.指示劑變色時,說明鹽酸與NaOH恰好完全反應
D.當滴加NaOH溶液10.00 mL(忽略反應前后體積變化),該混合液的pH=1+lg3
查看答案和解析>>
科目: 來源: 題型:
【題目】設NA表示阿伏加德羅常數,下列敘述中正確的是( )
A.常溫常壓下,11.2L氧氣所含的原子數為NA
B.標準狀況下,1.12L氦氣所含的原子數為0.1NA
C.1.8 g NH4+離子中含有的電子數為NA
D.15.6 g Na2O2與過量CO2反應時,轉移的電子數為0.4NA
查看答案和解析>>
科目: 來源: 題型:
【題目】已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判斷正確的是( )
A. 氫氣的燃燒熱:ΔH=-241.8 kJ·mol-1
B. 相同條件下,充分燃燒1 mol H2(g)與1 mol S(g)的混合物比充分燃燒1 mol H2S(g)放熱多20.1 kJ
C. 由①②知,水的熱穩定性小于硫化氫
D. ②中若生成固態硫,ΔH將增大
查看答案和解析>>
科目: 來源: 題型:
【題目】t ℃時,pH=2的稀硫酸和pH=11的NaOH溶液等體積混合后溶液呈中性,則該溫度下,1體積的稀硫酸和10體積的NaOH溶液混合后溶液呈中性,則稀硫酸的pH(pHa)與NaOH溶液的pH(pHb)的關系是( )
A.pHa+pHb=12B.pHa+pHb=13C.pHa+pHb=14D.pHa+pHb=15
查看答案和解析>>
科目: 來源: 題型:
【題目】根據如圖所示示意圖,下列說法不正確的是( )
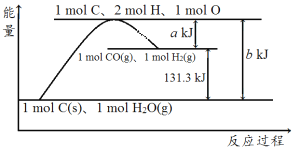
A.反應的熱化學方程式可表示為C(s)+H2O(g)=CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B.該反應過程反應物斷鍵吸收的能量大于生成物成鍵放出的能量
C.amol C和amol H2O(l)反應生成amol CO和a mol H2吸收的熱量一定為131.3a kJ
D.1mol C、2mol H、1mol O轉變成1mol CO(g)和1mol H2(g)放出的熱量為a kJ
查看答案和解析>>
科目: 來源: 題型:
【題目】粗硅提純常見方法之一是先將粗硅與HCl反應制得SiHCl3,經提純后再用H2還原:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)。在2L密閉容器中,不同溫度及不同n(H2)/n(SiHCl3)時,反應物X的平衡轉化率關系如圖。下列判斷合理的是
Si(s)+3HCl(g)。在2L密閉容器中,不同溫度及不同n(H2)/n(SiHCl3)時,反應物X的平衡轉化率關系如圖。下列判斷合理的是
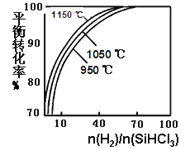
A. X是H2
B. 1150℃反應的平衡常數大于950℃時反應的平衡常數
C. 減小Si(s)的量,有利于提高SiHCl3的轉化率
D. 工業上可采用增大壓強的方法提高產率
查看答案和解析>>
科目: 來源: 題型:
【題目】四種短周期元素在周期表中的位置如圖,其中只有M為金屬元素下列說法不正確的是( )
![]()
A. Y的最高價氧化物對應水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的氣態氫化物的穩定性比Z的弱
D. M的原子半徑比Y的原子半徑大
查看答案和解析>>
科目: 來源: 題型:
【題目】可逆反應:2A(s)![]() B(g)+C(g)在體積固定的密閉容器中,起始時加入一定量的A,判斷反應達到平衡狀態的標志是: ①單位時間內生成2molA的同時生成1molB ②v(B):v(C)=1:1 ③密閉容器中混合氣體的平均摩爾質量不變 ④混合氣體的密度不再改變 ⑤B的體積分數不再改變 ⑥混合氣體的壓強不再改變的狀態
B(g)+C(g)在體積固定的密閉容器中,起始時加入一定量的A,判斷反應達到平衡狀態的標志是: ①單位時間內生成2molA的同時生成1molB ②v(B):v(C)=1:1 ③密閉容器中混合氣體的平均摩爾質量不變 ④混合氣體的密度不再改變 ⑤B的體積分數不再改變 ⑥混合氣體的壓強不再改變的狀態
A. ①③④⑤⑥ B. ①③④⑥ C. ①④⑥ D. 全部
查看答案和解析>>
科目: 來源: 題型:
【題目】已知W、X、Y、Z為短周期元素,W、Z同主族,X、Y、Z同周期,W的氣態氫化物的穩定性大于Z的氣態氫化物的穩定性,X、Y為金屬元素,X的陽離子的氧化性小于Y的陽離子的氧化性。下列說法正確的是( )
A.W與X元素的單質在常溫下不反應
B.X、Y、Z、W的原子半徑依次減小
C.W的氣態氫化物的沸點一定低于Z的氣態氫化物的沸點
D.若W與Y的原子序數相差5,則二者形成化合物的化學式一定為Y2W3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com