
科目: 來源: 題型:
【題目】某學生設計下列實驗(圖中用于加熱的儀器沒有畫出)制取Mg3N2,觀察到裝置A的黑色的固體變成紅色,裝置D的鎂條變成白色,回答下列問題:
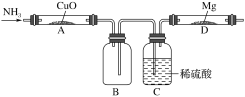
(1)裝置A中生成的物質是純凈物,則可能是_________,證明的方法是_____________。
(2)設計C裝置的作用是________________,缺陷是___________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】工業上通常利用SiO2 和碳反應來制取硅,寫出反應的化學方程式___________________。
工業上還可以利用鎂制取硅,反應為2Mg+SiO2 = 2MgO+Si,同時會發生副反應:2Mg + Si = Mg2Si。如圖是進行Mg與SiO2反應的實驗裝置,試回答下列問題:

(1)由于O2和H2O(g)的存在對該實驗有較大影響,實驗中應通入氣體X作為保護氣,試管中的固體藥品可選用________(填序號)。
a.石灰石 b.鋅粒 c.純堿
(2)實驗開始時,必須先通一段時間X氣體,再加熱反應物,其理由是 ___________________________;當反應引發后,移走酒精燈,反應能繼續進行,其原因是______________________。
(3)反應結束后,待冷卻至常溫時,往反應后的混合物中加入稀鹽酸,可觀察到閃亮的火星,產生此現象的原因是副產物Mg2Si遇鹽酸迅速反應生成SiH4(硅烷)氣體,然后SiH4自燃.用化學方程式表示這兩個反應①________________________②___________________.
查看答案和解析>>
科目: 來源: 題型:
【題目】有兩種金屬組成的合金A,在合適的條件下可按下圖進行反應(部分產物和水省略),已知F為紅褐色沉淀,請回答:
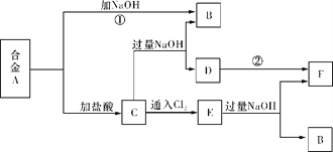
(1)溶液C的溶質主要是____________________(填化學式)。
(2)寫出反應②的化學方程式_______________________________________________。描述D變F的實驗現象_______________________________________________。
(3)寫出反應C→E的離子方程式________________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】為探究苯與溴的取代反應,甲用下圖裝置Ⅰ進行如下實驗:
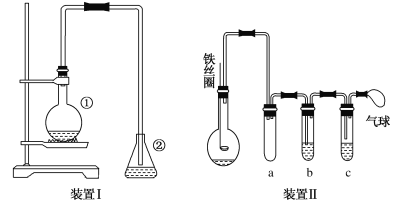
將一定量的苯和溴放在燒瓶中,同時加入少量鐵屑作催化劑,3~5分鐘后發現滴有AgNO3的錐形瓶中有淺黃色的沉淀生成,即證明苯與溴發生了取代反應。
(1)裝置Ⅰ中①的化學方程式為__________________________。
(2)燒瓶中生成的紅褐色油狀液滴的成分是溴苯和溴單質,要想得到純凈的產物,可用NaOH溶液試劑洗滌。洗滌后分離粗產品應使用的儀器是________________。
(3)乙同學設計上圖所示裝置Ⅱ,并用下列某些試劑完成該實驗。可選用的試劑是:苯;液溴;濃硫酸;氫氧化鈉溶液;硝酸銀溶液;四氯化碳。
a的作用是__________________。b中的試劑是___________________。比較兩套裝置,裝置Ⅱ的主要優點__________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】ClO2是一種黃綠色或橙黃色的氣體,極易溶于水,可用于水的消毒殺菌、水體中Mn2+等重金屬清除及煙氣的脫硫脫硝。回答下列問題:
(1)將過硫酸鈉(Na2S2O8)溶液加入亞氯酸鈉(NaClO2)中可制備ClO2,該反應中氧化劑和還原劑的物質的量之比為_____。
(2)將ClO2通入MnSO4溶液,溶液中可檢測到Cl-同時有黑色沉淀生成。該反應的離子方程式為__________。
(3)為研究ClO2脫硝的適宜條件,在1L200 mgL-1 ClO2溶液中加NaOH溶液調節pH,通入NO氣體并測定NO的去除率,脫硝后N元素以NO3-形式存在,其關系如下圖所示:
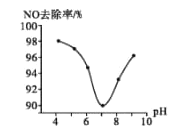
①實驗中使用的ClO2溶液的物質的量濃度為______(保留三位有效數字);要使NO的去除率更高,應控制的條件是_________。
②當溶液pH>7時,NO的去除率增大的原因是ClO2與NaOH溶液反應可生成更強的吸收劑NaClO2,寫出堿性條件下NaClO2脫除NO反應的離子方程式:_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】給下列有機物命名:
(1) 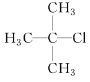 的系統命名為____________________________________。
的系統命名為____________________________________。
(2) 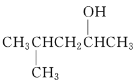 的系統命名為______________________________。
的系統命名為______________________________。
(3) 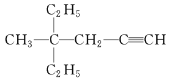 的系統命名為__________________________。
的系統命名為__________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】B.[實驗化學]
丙炔酸甲酯(![]() )是一種重要的有機化工原料,沸點為103~105 ℃。實驗室制備少量丙炔酸甲酯的反應為
)是一種重要的有機化工原料,沸點為103~105 ℃。實驗室制備少量丙炔酸甲酯的反應為
![]()
實驗步驟如下:
步驟1:在反應瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL濃硫酸,攪拌,加熱回流一段時間。
步驟2:蒸出過量的甲醇(裝置見下圖)。
步驟3:反應液冷卻后,依次用飽和NaCl溶液、5%Na2CO3溶液、水洗滌。分離出有機相。
步驟4:有機相經無水Na2SO4干燥、過濾、蒸餾,得丙炔酸甲酯。

(1)步驟1中,加入過量甲醇的目的是________。
(2)步驟2中,上圖所示的裝置中儀器A的名稱是______;蒸餾燒瓶中加入碎瓷片的目的是______。
(3)步驟3中,用5%Na2CO3溶液洗滌,主要除去的物質是____;分離出有機相的操作名稱為____。
(4)步驟4中,蒸餾時不能用水浴加熱的原因是________。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列反應中屬于可逆反應的是( )
①N2+3H2![]() 2NH3,2NH3
2NH3,2NH3![]() 3H2+N2
3H2+N2
②2NaHCO3![]() Na2CO3+H2O↑+CO2↑,Na2CO3+H2O+CO2===2NaHCO3
Na2CO3+H2O↑+CO2↑,Na2CO3+H2O+CO2===2NaHCO3
③CH3CH2OH![]() CH2===CH2↑+H2O,CH2===CH2+H—OH
CH2===CH2↑+H2O,CH2===CH2+H—OH![]() CH3CH2OH
CH3CH2OH
④2Na+Cl2![]() 2NaCl, 2NaCl
2NaCl, 2NaCl![]() 2Na+Cl2
2Na+Cl2
A.只有①B.①②③
C.①②③④D.①③④
查看答案和解析>>
科目: 來源: 題型:
【題目】某溫度時,濃度均為1 mol·L-1的兩種氣體X2和Y2,在密閉容器中發生可逆反應生成氣體Z。充分反應后,X2的濃度為0.4 mol·L-1,Y2的濃度為0.8 mol·L-1,生成氣體Z的濃度為0.4 mol·L-1。則該反應的化學方程式(Z用X、Y表示)是( )
A.X2(g)+2Y2(g) ![]() 2XY2(g)
2XY2(g)
B.2X2(g)+Y2(g) ![]() 2X2Y(g)
2X2Y(g)
C.X2(g)+3Y2(g) ![]() 2XY3(g)
2XY3(g)
D.3X2(g)+Y2(g) ![]() 2X3Y(g)
2X3Y(g)
查看答案和解析>>
科目: 來源: 題型:
【題目】酸雨治理,處理SO2尾氣方法較多:
(1)還原法
反應原理:恒溫恒容時2C(s)+2SO2(g)S2(g)+2CO2(g)。一定溫度下,反應進行到不同時刻測得各物質的濃度部分圖像如圖:
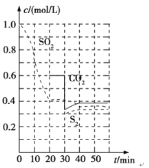
①0~20 min內反應速率表示為v(SO2)=________;
②30 min時,改變某一條件平衡發生移動,則改變的條件最有可能是________;
③該反應的平衡常數K=________。
(2)循環利用法
相關反應為①Na2SO3+SO2+H2O=2NaHSO3,②2NaHSO3![]() Na2SO3+SO2↑+H2O。下列說法正確的是________。
Na2SO3+SO2↑+H2O。下列說法正確的是________。
A.反應①進行時,溶液中c(SO32-)/c(HSO![]() )減小,反應②進行時,溶液中c(SO32-)/c(HSO3-)增大
)減小,反應②進行時,溶液中c(SO32-)/c(HSO3-)增大
B.反應①與反應②Kw均為10-14
C.循環利用的物質是Na2SO3溶液,尾氣中的氧氣對循環利用的次數有影響
D.反應①進行時,2c(SO32-)+c(HSO3-)+c(OH-)之和不變
(3)電解法
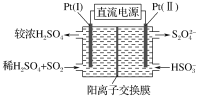
①如圖所示,Pt(Ⅰ)電極的反應式為________________;
②當電路中轉移0.02 mol e-時(較濃H2SO4尚未排出),交換膜左側溶液中約增加________ mol離子。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com