
科目: 來源: 題型:
【題目】濃度都是1mol/L的兩種氣體X2和Y2,在密閉容器中反應生成氣體Z,達到平衡后c(X(2)為0.4mol/L,c(Y(2)為0.8mol/L,生成的c(Z)為0.4mol/L,則該反應是
A.3X2+Y2![]() 2X3YB.X2+3Y2
2X3YB.X2+3Y2![]() 2XY3C.X2+2Y2
2XY3C.X2+2Y2![]() 2XY2D.2X2+Y2
2XY2D.2X2+Y2![]() 2X2Y
2X2Y
查看答案和解析>>
科目: 來源: 題型:
【題目】室溫下,將 0.10 mol·L-1 鹽酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 隨加入鹽酸體積變化曲線如圖所示。已知:pOH=-lg c(OH-),下列正確的是

A. M 點所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 點所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 點鹽酸與氨水恰好中和
D. M 點到Q點所示溶液中水的電離程度先變大后減小
查看答案和解析>>
科目: 來源: 題型:
【題目】對于反應2A+B![]() 3C+4D,表示反應速率最快的是
3C+4D,表示反應速率最快的是
A.VA=0.75mol/(L·s)B.VB=0.5mol/(L·s)C.VC=1.0mol/(L·s)D.VD=1.5mol/(L·s)
查看答案和解析>>
科目: 來源: 題型:
【題目】隨原子序數的遞增,五種短周期元素原子半徑與原子序數的關系如圖所示。
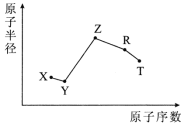
已知:TX2是現代光學及光纖制品的基本原料;
ZY 能破壞水的電離平衡;Z3RY6在工業上常用作助熔劑。
(1)R在元素周期表中的位置是___。
(2)上述元素中的某兩種元素可組成一種五原子共價化合物,該化合物的結構式為___。
(3)請用一個化學方程式比較X和Y的非金屬性的強弱_____。
(4)工業上以Z3RY6作助熔劑的目的是____。
查看答案和解析>>
科目: 來源: 題型:
【題目】(NH4)3Fe(C6H5O7)2(檸檬酸鐵銨)廣泛用于醫學、食品業等。實驗室由硫酸亞鐵和檸檬酸(  )等為原料制備檸檬酸鐵銨產品的主要實驗流程如圖:
)等為原料制備檸檬酸鐵銨產品的主要實驗流程如圖:
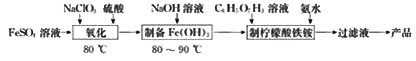
回答下列問題:
(1)“氧化”時,發生反應的離子方程式為________(ClO3-轉化為Cl-)。
(2)氧化后的溶液¨制備Fe(OH)3”的詳細實驗操作為:在不斷攪拌下,向氧化后的溶液中________。
(3)“制備檸檬酸鐵銨”的裝置(夾持及加熱裝置已略)如圖所示

①圖中儀器W的名稱是________。
②Fe(OH)3與檸檬酸反應時溫度需控制在65℃,適宜的加熱方法是________;待Fe(OH)3完全溶解后,需將溫度降到40℃后再滴加氨水,釆用較低溫度滴加氨水,其原因是________ 。
③合適的尾氣吸收裝置是________(填字母)。
(4)由“過濾液”得到產品還需經過的操作是蒸發濃縮、冷卻結晶、________、干燥。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知二元酸H2A的電離方程式為:H2A=H++HA-,HA-![]() H++A2-,下列有關該酸及鹽的說法正確的是
H++A2-,下列有關該酸及鹽的說法正確的是
A.0.1 mol/LH2A溶液pH=1
B.H2A為強酸
C.NaHA溶液呈酸性的原因是:HA-+H2O![]() H2A+OH-
H2A+OH-
D.Na2A在溶液中不水解,溶液呈中性
查看答案和解析>>
科目: 來源: 題型:
【題目】甲醇是一種重要的化工原料.
![]() 已知:
已知:![]()
![]()
寫出表示甲醇燃燒熱的熱化學方程式 ______ .
![]() 甲醇與水蒸氣催化重整可獲得清潔能源,具有廣泛的應用前景.其反應為:
甲醇與水蒸氣催化重整可獲得清潔能源,具有廣泛的應用前景.其反應為:
![]()
![]()
![]()
![]() 該反應的平衡常數表達式為 ______ .
該反應的平衡常數表達式為 ______ .
![]() 下列措施中能使平衡時
下列措施中能使平衡時![]() 減小的是
減小的是![]() 雙選
雙選![]() ______ .
______ .
A.加入催化劑![]() 恒容充入
恒容充入![]() ,使體系壓強增大
,使體系壓強增大
C.將![]() 從體系中分離
從體系中分離![]() 恒容再充入
恒容再充入![]()
![]() 甲醇可以氧化成甲酸,在常溫下用
甲醇可以氧化成甲酸,在常溫下用![]() NaOH溶液滴定
NaOH溶液滴定![]()
![]() 甲酸溶液過程中,當混合液的
甲酸溶液過程中,當混合液的![]() 時,所消耗的
時,所消耗的![]() ______span>
______span>
![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() .
.
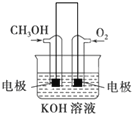
![]() 利用甲醇燃燒設計為燃料電池,如圖所示,則負極電極反應式為 ______ .
利用甲醇燃燒設計為燃料電池,如圖所示,則負極電極反應式為 ______ .
![]() 合成甲醇的主要反應為:
合成甲醇的主要反應為:![]() 原料氣的加工過程中常常混有一些
原料氣的加工過程中常常混有一些![]() ,為了研究溫度及
,為了研究溫度及![]() 含量對該反應的影響,以
含量對該反應的影響,以![]() 、CO和
、CO和![]() 的混合氣體為原料在一定條件下進行實驗.實驗數據見下表:
的混合氣體為原料在一定條件下進行實驗.實驗數據見下表:
|
|
|
|
| ||||||||
反應溫度 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
生成 |
|
|
|
|
|
|
|
|
|
|
|
|
由表中數據可得出多個結論.
結論一:在一定條件下,反應溫度越高,生成![]() 的碳轉化率 ______ .
的碳轉化率 ______ .
結論二: ______ .
查看答案和解析>>
科目: 來源: 題型:
【題目】關于沉淀溶解平衡和溶度積常數,下列說法不正確的是( )
A. Ksp只與難溶電解質的性質和溫度有關,而與溶液中的離子濃度無關
B. 將飽和Na2SO4溶液加入到飽和石灰水中,有白色沉淀產生,說明Ksp[Ca(OH)2]大于Ksp(CaSO4)
C. 已知25 ℃時Ksp[Fe(OH)3]=4.0×10-38,則該溫度下反應Fe(OH)3+3H+![]() Fe3++3H2O的平衡常數K=4.0×104
Fe3++3H2O的平衡常數K=4.0×104
D. 已知25 ℃時Ksp[Mg(OH)2] =1.8×10-11,在MgCl2溶液中加入氨水調混合液的pH=11,產生沉淀,則此時溶液中的c(Mg2+)=1.8×10-5mol·L-1
查看答案和解析>>
科目: 來源: 題型:
【題目】下列有關實驗操作、現象和結論都正確的是( )
選項 | 實驗操作 | 現象 | 結論 |
A | 稀硝酸溶液中加入過量鐵粉充分反應后,滴加KSCN溶液 | 溶液變為血紅色 | 稀硝酸具有氧化性,能將Fe氧化成Fe3+ |
B | 向AgNO3溶液中滴加過量氨水 | 溶液澄清 | Ag+與NH3·H2O能大量共存 |
C | 向某溶液中滴加稀NaOH溶液,將濕潤的紅色石蕊試紙置于試管口 | 試紙變藍 | 該溶液中存在NH4+ |
D | 向含有酚酞的Na2CO3溶液中加入少量的BaCl2固體 | 溶液紅色變淺 | 證明Na2CO3溶液中存在水解平衡 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 來源: 題型:
【題目】某新型藥物H(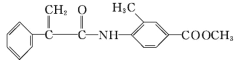 )是一種可用于治療腫瘤的藥物,其合成路線如圖所示:
)是一種可用于治療腫瘤的藥物,其合成路線如圖所示:
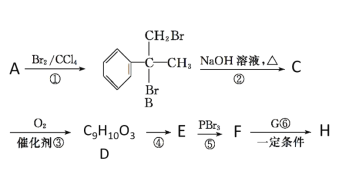
已知:①E的分子式為C9H8O2,能使溴的四氯化碳溶液褪色;
②RCOOH![]()
![]() (R為烴基);
(R為烴基);
③![]()
![]()
![]() 。
。
請回答下列問題:
(1)A的結構簡式為________;D的官能團的名稱為____________。
(2)①的反應類型是________。
(3)寫出B→C的化學方程式: ______________________________________。
(4)E有多種同分異構體,同時滿足下列條件的E的同分異構體的結構簡式_______。
ⅰ.能發生銀鏡反應
ⅱ.能發生水解反應
ⅲ.分子中含的環只有苯環,且苯環上只有一個取代基。
(5)參照合成H的上述路線,設計一條由乙醛和NH2CH(CH3)2為起始原料制備醫藥中間體CH3CONHCH(CH3)2的合成路線。
________________________________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com