
科目: 來源: 題型:
【題目】將氣體A、B置于固定容積為2 L的密閉容器中,發生如下反應:3A(g)+B(g)![]() 2C(g)+2D(g),反應進行到10 s末,達到平衡,測得A的物質的量為1.8 mol,B的物質的量為0.6 mol,C的物質的量為0.8 mol。
2C(g)+2D(g),反應進行到10 s末,達到平衡,測得A的物質的量為1.8 mol,B的物質的量為0.6 mol,C的物質的量為0.8 mol。
(1)用C表示10 s內反應的平均反應速率為____。
(2)反應前A的物質的量濃度是____。
(3)10 s末,生成物D的濃度為__。
(4)A與B的平衡轉化率之比為___。
(5)反應過程中容器內氣體的平均相對分子質量變化是_(填“增大”、“減小”或“不變”,下同),氣體的密度變化是___。
(6)平衡后,若改變下列條件,生成D的速率如何變化(填“增大”、“減小”或“不變”):
①降低溫度____;②增大A的濃度_____;
③恒容下充入氖氣________。
(7)下列敘述能說明該反應已達到化學平衡狀態的是(填標號)___;
A.v(B)=2v(C)
B.容器內壓強不再發生變化
C.A的體積分數不再發生變化
D.器內氣體密度不再發生變化
E.相同時間內消耗n mol的B的同時生成2n mol的D
(8)將固體NH4I置于密閉容器中,在某溫度下發生下列反應:NH4I(s) ![]() NH3(g)+HI(g),2HI(g)
NH3(g)+HI(g),2HI(g) ![]() H2(g)+I2(g)。當反應達到平衡時,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,則NH3的濃度為___。
H2(g)+I2(g)。當反應達到平衡時,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,則NH3的濃度為___。
查看答案和解析>>
科目: 來源: 題型:
【題目】由化合物A制備一種醫藥合成中間體G和可降解環保塑料PHB的合成路線如下:
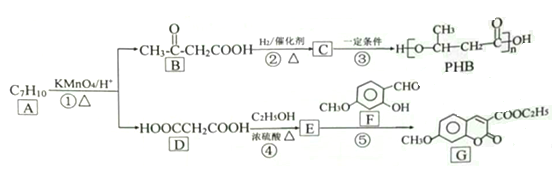
己知: ![]() (-R1、-R2、-R3均為烴基)
(-R1、-R2、-R3均為烴基)
回答下列問題:
(1)A的結構簡式___________,G中含氧官能團的名稱____________________。
(2)反應①和③的反應類型分別是_____________、________________。
(3)C存在多種同分異構體,其中分別與足量的NaHCO3溶液和Na反應產生氣體的物質的量相同的同分異構體的數目為______種。
(4)寫出反應③的化學方程式__________________________________
(5)寫出滿足下列條件的B的同分異構體_________________________
①能發生銀鏡反應 ②分子中烴基上的氫原子被取代后的一氯代物只有一種
(6)寫出用B為起始原料制備高分子化合物![]() 的合成路線(其
的合成路線(其
他試劑任選)。____________________________________________
(7)上述合成路線中最后一步反應的化學方程式為:______________________
查看答案和解析>>
科目: 來源: 題型:
【題目】某興趣小組以廢鐵屑制得硫酸亞鐵銨后,按下列流程制備二水合草酸亞鐵(FeC2O4·2H2O),進一步制備高純度還原鐵粉。
已知:FeC2O4·2H2O難溶于水,150℃開始失結晶水;常溫下H2C2O4為晶體,易溶于水,溶解度隨溫度升高而增大。

請回答:
(1)步驟②,發生反應的離子方程式____________________________;該步驟H2C2O4稍過量主要是為了_________________。
(2)下列操作或描述正確的是_______________。
A.步驟①,酸化主要是為了抑制Fe2+水解
B.步驟③,如果采用冷水洗滌可提高除雜效果
C.步驟③,如果在常壓下快速干燥,溫度可選擇略高于100℃
(3)稱取一定量的FeC2O4·2H2O試樣,用硫酸溶解,采用KMnO4滴定法測定,折算結果如下:
n(Fe2+)/mol | n(C2O42-)·mol-1 | 試樣中FeC2O4·2H2O的質量分數 |
9.80×10-4 | 9.80×10-4 | 0.98 |
由表中數據推測試樣中最主要的雜質是_________________。
(4)實現步驟④必須用到的兩種儀器是_________(供選儀器如下)
a.坩堝;b.燒杯;c.蒸餾燒瓶;d.錐形瓶;e.表面皿:f.高溫爐
該步驟的化學方程式是______________________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】以苯為主要原料,制取高分子材料N和R的流程如下:
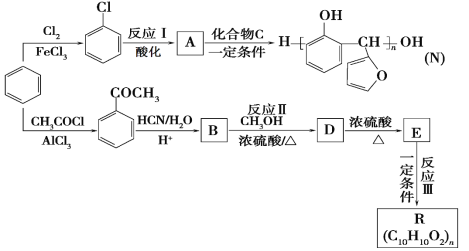
已知: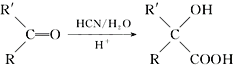
(1)B中含氧官能團的名稱是_____________。
(2)由![]() 生成
生成![]() 的反應類型是_____________。
的反應類型是_____________。
(3)一定條件下,發生反應Ⅰ所需的其他反應試劑是_____________。
(4)化合物C的結構簡式是_____________。
(5)反應Ⅲ的化學反應方程式是_____________。
(6)下列說法正確的是_____________。(填字母)。
a.A可與NaOH溶液反應 b.常溫下,A能和水以任意比混溶
c.化合物C可使酸性高錳酸鉀溶液褪色 d.E存在順反異構體
(7)符合下列條件的B的同分異構體有____________種。
a.能與飽和溴水反應生成白色沉淀
b.屬于酯類
c.苯環上只有兩個對位取代基
查看答案和解析>>
科目: 來源: 題型:
【題目】某化合物6.4 g在氧氣中完全燃燒,只生成8.8 g CO2和7.2 g H2O。下列說法正確
A.該化合物僅含碳、氫兩種元素B.該化合物中碳、氫原子個數比為1:3
C.無法確定該化合物是否含有氧元素D.該化合物中一定含有氧元素
查看答案和解析>>
科目: 來源: 題型:
【題目】有機物X的結構![]()
![]() 其中Ⅰ、Ⅱ為未知部分的結構
其中Ⅰ、Ⅱ為未知部分的結構![]() 下列是X發生反應的轉化關系圖及E的信息.
下列是X發生反應的轉化關系圖及E的信息.
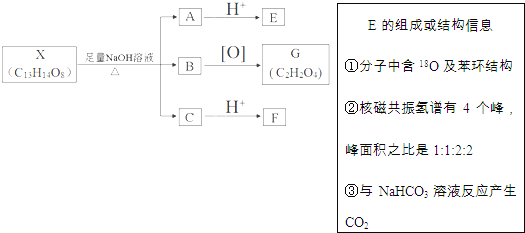
回答下列問題:
![]() 中官能團的名稱為 ______ ,F不能發生和化學反應類型有 ______
中官能團的名稱為 ______ ,F不能發生和化學反應類型有 ______
A.取代反應 ![]() 加成反應
加成反應 ![]() 氧化反應
氧化反應 ![]() 消去反應
消去反應
![]() 的分子式為 ______ B與G反應可生成高分子化合物M,其化學方程式是 ______
的分子式為 ______ B與G反應可生成高分子化合物M,其化學方程式是 ______
![]() 在足量NaOH溶液中反應的化學方程式為 ______
在足量NaOH溶液中反應的化學方程式為 ______
![]() 化合物E有多種同分異構體,滿足下列條件的所有同分異構體有 ______ 種,任寫其中一種的結構簡式為 ______
化合物E有多種同分異構體,滿足下列條件的所有同分異構體有 ______ 種,任寫其中一種的結構簡式為 ______
![]() 遇氯化鐵溶液顯紫色;
遇氯化鐵溶液顯紫色;![]() 分子中除苯環外物其中它環;
分子中除苯環外物其中它環;![]() 能發生眼鏡反應.
能發生眼鏡反應.
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖為原電池裝置示意圖。
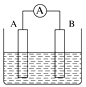
(1)將鋁片和銅片用導線相連,一組插入濃硝酸中,一組插入燒堿溶液中,分別形成了原電池,在這兩個原電池中,作負極的分別是__(填字母)。
A 鋁片、銅片 B 銅片、鋁片
C 鋁片、鋁片 D 銅片、銅片
寫出插入燒堿溶液中形成的原電池的負極反應式:____。
(2)若A為Pb,B為PbO2,電解質為H2SO4溶液,工作時的總反應為Pb+PbO2+2H2SO4=2PbSO4+2H2O。寫出B電極反應式:___;該電池在工作時,A電極的質量將_(填“增加”“減小”或“不變”)。若該電池反應消耗了0.1 mol H2SO4,則轉移電子的數目為__。
(3)若A、B均為鉑片,電解質為KOH溶液,分別從A、B兩極通入H2和O2,該電池即為氫氧燃料電池,寫出B電極反應式:_________;該電池在工作一段時間后,溶液的堿性將___(填“增強”“減弱”或“不變”)。
(4)若A、B均為鉑片,電解質為H2SO4溶液,分別從A、B兩極通入CH4和O2,該電池即為甲烷燃料電池,寫出A電極反應式:________;若該電池反應消耗了6.4克CH4,則轉移電子的數目為__。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知充分燃燒a g乙炔氣體時生成1mol二氧化碳氣體和液態水,并放出熱量b kJ,則乙炔燃燒的熱化學方程式正確的是()
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=+2b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-b kJ/mol
查看答案和解析>>
科目: 來源: 題型:
【題目】甲醇(CH3OH)和二甲醚(CH3OCH3)被稱為21世紀的新型燃料,具有清潔、高效等性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有關反應的熱化學方程式如下:
CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) △H=-49.0 kJ·mol-1
2CH3OH(g)=CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
H2O(l)=H2O(g) △H= + 44 kJ·mol-1
則CO2與H2反應合成二甲醚生成液態水的熱化學方程式為:____________________。
(2)工業上合成甲醇的反應:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能說明該反應在恒溫恒容條件下已達化學平衡狀態的是___________
CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能說明該反應在恒溫恒容條件下已達化學平衡狀態的是___________
A.v正(H2) = 2v逆(CH3OH) B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合氣體的密度不變 D.混合氣體的平均相對分子質量不變 E.容器的壓強不變
(3)若反應2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)在某溫度下的化學平衡常數為400,此溫度下,在密閉容器中加入一定量甲醇,反應進行到某時刻,測得各物質的濃度如下表所示:
CH3OCH3(g) + H2O(g)在某溫度下的化學平衡常數為400,此溫度下,在密閉容器中加入一定量甲醇,反應進行到某時刻,測得各物質的濃度如下表所示:
物質 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
濃度(mol·L-1) | 0.44 | 0.60 | 0.60 |
①比較該時刻正、逆反應速率的大小:v(正)_____v(逆)(填“>”、“<”或“=”)。
②若加入甲醇后,經10 min反應達到平衡,則平衡后c(CH3OH)=______________,
該時間內反應速率v(CH3OCH3)=_____________。
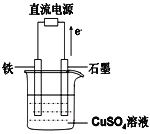
(4)利用二甲醚(CH3OCH3)設計一個燃料電池,用KOH溶液作電解質溶液,石墨做電極,該電池負極電極反應式為___________________________。以此燃料電池作為外接電源按如圖所示電解硫酸銅溶液,如果起始時盛有1000mLpH=5的硫酸銅溶液(25℃,CuSO4足量),一段時間后溶液的pH變為1,若要使溶液恢復到起始濃度(溫度不變,忽略溶液體積的變化),可向溶液中加入______其質量約為_____g。
查看答案和解析>>
科目: 來源: 題型:
【題目】化合物D是硅橡膠的穩定劑,其合成路線如下圖
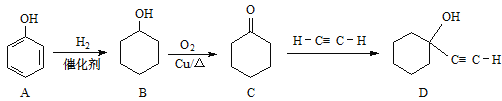
(1)B的分子式為____; C中官能團名稱___。
(2)C→D的反應類型為___。
(3)B→C的化學方程式為___。
(4)化合物D可能具有的性質有___(選填序號)。
a.與FeCl3溶液發生顯色反應
b.加成反應
c.消去反應
d.酯化反應
(5)化合物B經3步反應可制備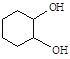 ,反應類型依次是___(選填序號)。
,反應類型依次是___(選填序號)。
a.加成 、 取代、 消去
b.消去、加成、取代
c.取代、消去、加成
(6)寫出同時滿足下列條件的A的一種同分異構體的結構簡式_____。
①核磁共振氫譜只有一個峰
②分子中沒有碳碳雙鍵也無環狀結構
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com