
科目: 來源: 題型:
【題目】下列說法正確的是( )
A. ![]() 和
和![]() 互為同素異形體 B. 紅磷和白磷互為同位素
互為同素異形體 B. 紅磷和白磷互為同位素
C. 鄰二甲苯和對二乙苯互為同系物 D. CH3C(CH3)2CH3和![]() 互為同分異構體
互為同分異構體
查看答案和解析>>
科目: 來源: 題型:
【題目】在恒溫條件下,向盛有食鹽的2L恒容密閉容器中加入0.2molNO2、0.2molNO和0.1molCl2,發生如下兩個反應:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0平衡常數K1
NaNO3(s)+ClNO(g) △H1<0平衡常數K1
②2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 平衡常數K2
2ClNO(g) △H2<0 平衡常數K2
10分鐘時反應達到平衡,測得容器內體系的壓強減少20%,10分鐘內用ClNO(g)表示的平均反應速率v(ClNO)=7.5×10-3mol/(Lmin)。下列說法不正確的是( )
A.反應4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常數為
2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常數為![]()
B.平衡后c(Cl2)=2.5×10-2mol/L
C.其它條件保持不變,反應在恒壓條件下進行,則平衡常數K2增大
D.平衡時NO2的轉化率為50%
查看答案和解析>>
科目: 來源: 題型:
【題目】根據反應KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)設計如下原電池,其中甲、乙兩燒杯中各物質的物質的量濃度均為1 mol·L-1,溶液的體積均為200 mL,鹽橋中裝有飽和K2SO4溶液。下列說法不正確的是( )
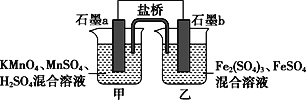
A. 石墨b是原電池的負極,發生氧化反應
B. 甲燒杯中的電極反應式:MnO4-+5e-+8H+===Mn2++4H2O
C. 電池工作時,鹽橋中的陰陽離子分別向乙甲燒杯中移動,保持溶液中的電荷平衡
D. 忽略溶液體積變化,Fe2(SO4)3濃度變為1.5 mol/L,則反應中轉移的電子為0.1 mol
查看答案和解析>>
科目: 來源: 題型:
【題目】“綠色”和“生態文明”是未來的發展主題,而CO2的有效利用可以緩解溫室效應,解決能源短缺問題。
(1)CO2與CH4經催化重整,制得合成氣:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
已知:反應1 CH4(g)═C(s)+2H2(g) △H1= +75kJ/mol
反應2 2CO(g)═C(s)+CO2(g) △H2=-172kJ/mol
則該催化重整反應的△H=___kJmol-1。
(2)有科學家提出可利用FeO吸收CO2:6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s),對該反應的描述正確的是__。
2Fe3O4(s)+C(s),對該反應的描述正確的是__。
A.增大FeO的投入量,利于平衡正向移動
B.壓縮容器體積,可增大CO2的轉化率,c(CO2)減小
C.恒溫恒容下,氣體的密度不變可作為平衡的標志
D.恒溫恒壓下,氣體摩爾質量不變可作為平衡的標志
E.若該反應的△H﹤0,則達到化學平衡后升高溫度,CO2的物質的量會增加
(3)為研究CO2與CO之間的轉化,讓一定量的CO2與足量碳在體積可變的密閉容器中反應:C(s)+CO2(g)![]() 2CO(g) H,測得壓強、溫度對CO的體積分數[φ(CO)%]的影響如圖所示,回答下列問題:
2CO(g) H,測得壓強、溫度對CO的體積分數[φ(CO)%]的影響如圖所示,回答下列問題:
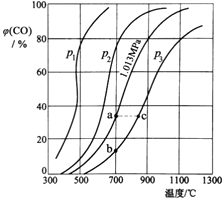
①圖中p1、p2、p3的大小關系是______,圖中a、b、c三點對應的平衡常數Ka、Kb、Kc的大小關系是______。
②900℃、1.013MPa時,1molCO2與足量碳反應達平衡后容器的體積為VL,CO2的轉化率為___(保留一位小數),該反應的平衡常數K=___。
③將②中平衡體系溫度降至640℃,壓強降至0.1013MPa,重新達到平衡后CO2的體積分數為50%。條件改變時,正反應速率______逆反應速率(填“>”、“<”或“=”)。
(4)在NaOH溶液中通入一定量的CO2氣體,所得溶液中c(HCO3-):c(CO32-)=4:1,此時溶液pH=______。(已知:室溫下,H2CO3的k1=4×10-7,k2=5×10-11。lg2=0.3)
查看答案和解析>>
科目: 來源: 題型:
【題目】合成氣(CO和H2)是目前化工常用的原料,下面是用甲烷制備合成氣的兩種方法:
① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
② 2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
其中一個反應的反應過程與能量變化關系如圖所示。則下列說法正確的是( )

A. E1表示2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g)的活化能
2CO(g)+4H2(g)的活化能
B. E2表示CH4(g)+H2O(g)![]() CO(g)+3H2(g)的活化能
CO(g)+3H2(g)的活化能
C. 該圖示為反應②的反應過程與能量變化示意圖
D. 一般情況下,加入催化劑,既能降低E1,也能降低E2,但不能改變E1與E2的差值
查看答案和解析>>
科目: 來源: 題型:
【題目】下列化學方程式書寫錯誤的是( )
A.NaHCO3水解的離子方程式:HCO3-+ H2O![]() CO32-+H3O+
CO32-+H3O+
B.NH4Cl水解的化學方程式:NH4Cl+H2O![]() NH3·H2O+HCl
NH3·H2O+HCl
C.Al(OH)3的兩性電離方程式:H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH
Al3++3OH
D.NaHSO3的電離方程式:NaHSO3=Na++HSO3-
查看答案和解析>>
科目: 來源: 題型:
【題目】已知膽礬溶于水時溶液溫度降低,室溫下將1mol無水硫酸銅制成溶液時放出熱量為Q1kJ,又知膽礬分解的熱化學方程式為CuSO45H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2kJmol-1則Q1、Q2的關系為
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 無法確定
查看答案和解析>>
科目: 來源: 題型:
【題目】有機物A可由葡萄糖發酵得到,也可從酸牛奶中提取.純凈的A為無色粘稠液體,易溶于水。為研究A的組成與結構,進行了如下實驗:
(1)稱取A9.0g,升溫使其汽化,測其密度是相同條件下H2的45倍。則A的相對分子質量為:___。
(2)將此9.0gA在足量純O2充分燃燒,并使其產物依次緩緩通過濃硫酸、堿石灰,發現兩者分別增重5.4g和13.2g。則A的分子式為:___。
(3)另取A9.0g,跟足量的NaHCO3粉末反應,生成2.24LCO2(標準狀況),若與足量金屬鈉反應則生成2.24LH2(標準狀況)。用結構簡式表示A中含有的官能團為:___、__。
(4)A的核磁共振氫譜如圖:則A中含有___種氫原子。
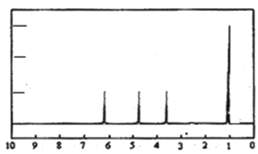
(5)綜上所述,A的結構簡式為___,跟NaHCO3溶液反應的離子方程式為___。
查看答案和解析>>
科目: 來源: 題型:
【題目】在一定溫度下的定容容器中,發生反應:2A(g)+B(s)![]() C(g)+D(g),下列描述中能表明反應已達到平衡狀態的是
C(g)+D(g),下列描述中能表明反應已達到平衡狀態的是
①混合氣體的壓強不變
②混合氣體的密度不變
③C(g)的物質的量濃度不變
④容器內A、C、D三種氣體的濃度之比為2:1:1
⑤單位時間內生成n molD,同時生成2n mol A
⑥單位時間內生成n molC,同時消耗n mol D
A. ①②③ B. ③④⑥ C. ②③⑤⑥ D. 只有 ③
查看答案和解析>>
科目: 來源: 題型:
【題目】常溫下,向100 mL 0.1 mol·L-1 HA溶液中逐滴加入0.2 mol·L-1 MOH溶液,所得溶液的pH變化曲線如圖所示。下列有關說法正確的是 ( )
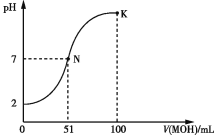
A.HA的電離方程式:HA![]() H++A-
H++A-
B.N點、K點水的電離程度:N<K
C.N點溶液中:c(A-)=c(M+)=c(H+)=c(OH-)
D.K點溶液中:c(OH-)+c(MOH)+c(A-)-c(H+)=0.1 mol·L-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com