
科目: 來源: 題型:
【題目】某實驗小組探究AgNO3溶液與Na2SO3溶液的反應。
實驗I | 操作 | 現象 |
| 滴加5滴0.1mol/L Na2SO3溶液,振蕩 | 產生白色沉淀,測得混合溶液pH=5 |
繼續滴加0.1mol/L Na2SO3溶液,振蕩 | 白色沉淀增多,繼續滴加,白色沉淀消失,測得混合溶液pH=9 |
資料:Ag2SO3,白色固體,難溶于水;Ag2SO4,白色固體,微溶于水;AgOH,白色固體,常溫下不穩定,易分解產生棕褐色固體。
(1)測得0.1mol/L Na2SO3溶液pH=10,用離子方程式解釋原因:_______。
(2)實驗小組對白色沉淀的成分提出猜想:
①可能含Ag2SO3。
②可能含Ag2SO4,理由是________。
③可能含AgOH。
實驗產生的白色沉淀放置一段時間后未發生明顯變化,排除猜想③。
(3)檢驗白色沉淀的成分
(資料:Ag++2S2O32![]() Ag(S2O3)23,Ag(S2O3)23在溶液中穩定存在。)
Ag(S2O3)23,Ag(S2O3)23在溶液中穩定存在。)
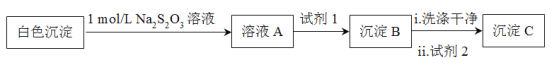
測得沉淀C質量小于沉淀B,試劑1和試劑2分別是_____、______,說明白色沉淀是Ag2SO3和Ag2SO4的混合物。
(4)探究白色沉淀消失的原因。實驗小組設計對照實驗:
實驗II | 實驗III | |
實驗操作 |
|
|
現象 | 沉淀溶解 |
① 補充實驗III的實驗操作及現象:_______,證明SO32使白色沉淀溶解。
② 查閱資料:Ag2SO3能溶于過量Na2SO3溶液中形成Ag(SO3)23。白色沉淀中含有g2SO4,但還能全部溶解于Na2SO3溶液的原因是______。
(5)探究AgNO3溶液與Na2SO3溶液能否發生氧化還原反應。
實驗IV | 操作 | 現象 |
| 步驟i:滴加一定體積0.1 mol/L Na2SO3溶液 | 產生白色沉淀 |
步驟ii:再加入NaOH溶液調pH=14,振蕩 | 白色沉淀變黑,經檢驗為Ag |
步驟ii中Ag2SO3發生反應的離子方程式是_________。
(6)綜合實驗I和IV,說明AgNO3溶液與Na2SO3溶液的反應類型與_______有關。
查看答案和解析>>
科目: 來源: 題型:
【題目】A(C2H4)是基本的有機化工原料。用A和常見的有機物可合成一種醚類香料和一種縮醛類香料,具體合成路線如圖所示(部分反應條件略去):

已知:

回答下列問題:
(1)B的分子式是___________,C中含有的官能團名稱是 ____________。
(2)若D為單取代芳香族化合物且能與金屬鈉反應;每個D分子中只含有1個氧原子,D中氧元素的質量分數約為13.1%,則D的結構簡式為___________,⑥的反應類型是________________。
(3)據報道,反應⑦在微波輻射下,以NaHSO4·H2O為催化劑進行,請寫出此反應的化學方程式:____________________________________。
(4)請寫出滿足下列條件的苯乙醛的所有同分異構體的結構簡式:___________________。
i .含有苯環和![]() 結構
結構
ii.核磁共振氫譜有4組峰,且峰面積之比為3∶2∶2∶1
(5)若化合物E為苯甲醚的同系物,且相對分子質量比苯甲醚大14,則能使FeCl3溶液顯色的E的所有同分異構體共有(不考慮立體異構)________________種。
(6)參照 的合成路線,寫出由2-氯丙烷和必要的無機試劑制備
的合成路線,寫出由2-氯丙烷和必要的無機試劑制備 的合成流程圖:_______________________________________
的合成流程圖:_______________________________________
合成流程圖示例如下:CH2 = CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目: 來源: 題型:
【題目】硼酸(H3BO3)大量應用于玻璃制造行業,以硼鎂礦(含2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)為原料生產硼酸的工藝流程如下:
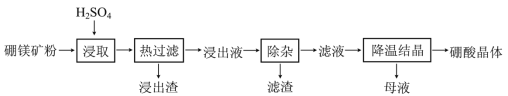
已知:H3BO3在20℃、40℃、60℃、100℃時的溶解度依次為5.0 g、8.7 g、14.8 g、40.2g。Fe3+、Al3+、Fe2+和Mg2+以氫氧化物形式完全沉淀時,溶液的pH分別為3.2、5.2、9.7和12.4。
(1)“浸取”時主要反應的化學方程式為_____________________。
(2)“浸取”后,采用“熱過濾”的目的是___________________________。
(3)“浸出液”顯酸性,含H3BO3和Mg2+、SO42-,還含有其他雜質。“除雜”時向浸出液中依次加入適量H2O2和MgO,除去的雜質離子是__________。H2O2的作用是______(用離子方程式表示)。
(4)“母液”可用于回收硫酸鎂,已知硫酸鎂的溶解度隨溫度變化的曲線如圖,且溶液的沸點隨壓強增大而升高。為了從“母液”中充分回收MgSO4H2O,應采取的措施是將“母液”蒸發濃縮后,最佳結晶條件是_____________。
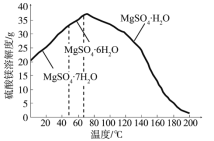
A. 升溫結晶 B. 降溫結晶 C. 加壓升溫結晶 D. 降壓降溫結晶
(5)在實際生產中為了提高原料的綜合利用率,可以利用除雜后濾渣作為提煉鋁的原料,工藝流程為:
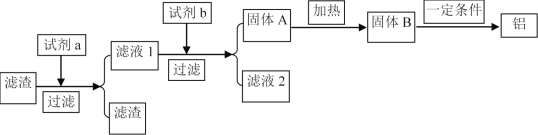
試劑a可選用________(化學式)溶液,若試劑b為AlCl3則由濾液得固體A的離子反應方程式為___________,在實際工業生產中,流程中的一定條件指的是________。
查看答案和解析>>
科目: 來源: 題型:
【題目】甲同學設計并進行了如下實驗,以探究乙炔與溴的加成反應:先取一定量工業用電石與水反應,將生成的氣體通入足量的溴水中,發現溶液褪色,即證明乙炔與溴水發生了加成反應。乙同學發現在甲同學的實驗中,褪色的溶液里有少許黃色渾濁,推測在制得乙炔中還可能含有少量還原性的雜質氣體,由此他提出必須先除去之,再與溴水反應。請你回答下列問題:
(1)寫出甲同學實驗中的兩個化學方程式:_______________、____________。
(2)乙認為甲設計的實驗不能驗證此反應為加成反應,其理由是________________。
A.使溴水褪色的物質,就是乙炔
B.使溴水褪色的反應就是加成反應
C.使溴水褪色的物質,未必是乙炔
D.使溴水褪色的反應未必是加成反應
(3)乙同學推測此乙炔中必定含有的一種雜質氣體是_________,在驗證過程中必須全部除去,它與溴水反應的化學方程式是________________________________________________________。
(4)請你選用下列三個裝置(見下圖)(可重復使用)來實現乙同學的實驗方案,將它們的編號填入方框,并寫出裝置內所放的化學藥品。
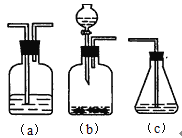
![]()
___、___、___、___
(5)為驗證這一反應是加成而不是取代,丙同學提出可用pH試紙來測試反應后溶液的酸性,理由是___。
查看答案和解析>>
科目: 來源: 題型:
【題目】請按要求填空:
(1)①![]() 的名稱為:___;
的名稱為:___;
②![]() 的名稱為:___;
的名稱為:___;
③苯酚與濃溴水反應的化學方程式:___;
④甲醛與新制氫氧化銅懸濁液反應的化學方程式:___。
⑤某有機化合物A的分子式為C5H11Br,分子結構中有三個—CH3,兩個![]() ,一個—Br,則A的結構簡式為___。
,一個—Br,則A的結構簡式為___。
(2)某有機物A的相對分子質量為74,且紅外光譜圖如圖,則A的結構簡式為__。
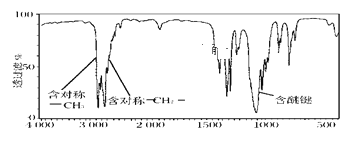
(3)1體積某烴的蒸氣完全燃燒生成的CO2比生成的水蒸氣少1體積(在同溫同壓下測定)。0.1mol該烴完全燃燒的產物被堿石灰吸收,堿石灰增重39g。該烴的分子式為__;若該烴的一氯代物有3種,寫出該烴所有可能的結構簡式__。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列關于有機物的說法正確的是
A. 苯佐卡因(![]() )是局部麻醉藥,分子中含有2種官能團,分子式為C9H10NO2
)是局部麻醉藥,分子中含有2種官能團,分子式為C9H10NO2
B. 香葉醇( )能發生加成反應不能發生取代反應
)能發生加成反應不能發生取代反應
C. 青蒿素(![]() ) 的一氯代物有5種(不含立體異構)
) 的一氯代物有5種(不含立體異構)
D. 某有機物的分子式為C4H8,能使溴的CCl4溶液褪色,則它在一定條件下與水反應時最多可生成的有機物(不考慮立體異構)有4種
查看答案和解析>>
科目: 來源: 題型:
【題目】“瘦肉精”是一種能減少脂肪增加瘦肉的藥品,有很危險的副作用,輕則導致心律不齊,重則導致心臟病。下列關于兩種常見瘦肉精的說法不正確的是( )
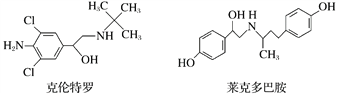
A.克倫特羅分子的分子式為C12H18ON2Cl2
B.克倫特羅能發生加成、氧化、消去等反應
C.克倫特羅和萊克多巴胺可以用FeCl3溶液鑒別
D.萊克多巴胺與足量NaOH溶液反應,生成物的化學式為C18H20NO3Na3
查看答案和解析>>
科目: 來源: 題型:
【題目】有X、Y、Z、W、Q五種元素,它們的核電荷數依次增大,且都小于20,其中X為非金屬元素。X和Q屬于同一族,它們原子的最外層電子排布式為ns1;Y和W也屬于同一族,它們原子的最外層的p能級電子數是s能級電子數的兩倍;Z原子最外層上電子數等于W原子最外層上電子數的一半。請回答下列問題:
(1)X、Y可形成一種綠色氧化劑A,則A為__(“極性分子”或“非極性分子”);試寫出Cu、稀硫酸與A反應制備CuSO4的離子方程式___。
(2)由這5種元素組成的一種化合物是__(填化學式),該物質主要用途是__,并解釋其原理___。
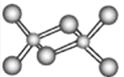
(3)在第四周期中,與Z元素原子未成對電子數相同的金屬元素有___種,該元素氯化物的二聚分子結構如圖所示,在此化合物中Z原子的雜化類型為___,該化合物在熔融狀態下___導電(“能”或“不能”)。
(4)分子WY2、WY3的鍵角相比,更大的是___(填化學式),寫出兩種與WY3互為等電子體的微粒___。
查看答案和解析>>
科目: 來源: 題型:
【題目】利用甲醇和水蒸氣重整為燃料電池提供氫氣。甲醇和水蒸氣重整的主要反應是:反應i:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H1= +49 kJ/mol。同時,存在副反應:反應ii:CH3OH(g)
CO2(g)+3H2(g) △H1= +49 kJ/mol。同時,存在副反應:反應ii:CH3OH(g)![]() CO(g)+2H2(g) △H2= +91 kJ/mol
CO(g)+2H2(g) △H2= +91 kJ/mol
(1)反應i的平衡常數K的表達式是_______。
(2)為探究條件對反應i平衡的影響,X、 Y(Y1、Y2)可分別代表壓強或溫度。下圖表示Y一定時,反應i中H2O(g)的平衡轉化率隨X的變化關系。

① X代表的物理量是_______。
② 判斷Y1_______Y2(填“>”或“<”),理由是_______。
(3)CO易使反應i的催化劑中毒,研究溫度和投料比對甲醇轉化率及重整氣中CO物質的量分數的影響,結果如圖所示。

①選擇250℃、水/甲醇投料比為2作為最佳條件進行反應,原因是_______。
②250℃時CO物質的量分數始終高于200℃時CO物質的量分數的原因可能是_______。
查看答案和解析>>
科目: 來源: 題型:
【題目】為了確認乙酸、碳酸和硅酸的酸性強弱,有人設計用如圖所示裝置,一次實驗達到目的(不能再選用其他酸性溶液)。

(1)錐形瓶內裝有某種可溶性正鹽固體(含有3種酸的酸根的其中一種),此固體為________,分液漏斗中所盛試劑是___。
(2)裝置B中所盛試劑的名稱是________,試劑的作用是__________。
(3)裝置C中出現的現象是__________________。
(4)由實驗可知三種酸的酸性大小順序為________(用化學式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com