
科目: 來源: 題型:
【題目】如圖所示甲是某學生驗證銅和濃硝酸反應的裝置,乙、丙是另外兩位同學對甲裝置改進后的裝置:

(1)甲、乙、丙三個裝置中都發生的反應的化學方程式:__。
(2)和甲裝置相比,乙裝置的優點是
①__;
②__。
(3)為了進一步驗證NO2和水的反應,某學生設計了丙裝置。實驗時先關閉止水夾__,再打開止水夾__,才能使NO2氣體充滿②試管;當氣體充滿②試管后,將銅絲提起與溶液脫離。欲使燒杯中的水進入②試管,應該__。
查看答案和解析>>
科目: 來源: 題型:
【題目】活性炭可處理大氣污染物NO,反應原理:C(s)+2NO(g)![]() N2(g)+CO2(g)。T℃時,在2L密閉容器中加入0.100molNO和2.030mol活性炭(無雜質),平衡時活性炭物質的量是2.000mol。下列說法不合理的是
N2(g)+CO2(g)。T℃時,在2L密閉容器中加入0.100molNO和2.030mol活性炭(無雜質),平衡時活性炭物質的量是2.000mol。下列說法不合理的是
A.該溫度下的平衡常數是:K=![]()
B.達到平衡時,NO的轉化率是60%
C.3min末達到平衡,則v(NO)=0.01mol/(L·min)
D.若平衡時再加入0.100molNO,則達到新平衡時NO的轉化率比原平衡時低
查看答案和解析>>
科目: 來源: 題型:
【題目】青蒿素是烴的含氧衍生物,為無色針狀晶體,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中幾乎不溶,熔點為156~157℃,熱穩定性差,青蒿素是高效的抗瘧藥。已知:乙醚沸點為35℃。從青蒿中提取青蒿素的方法之一是以萃取原理為基礎的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工藝為:
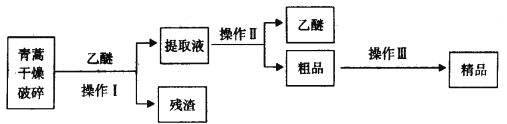
請回答下列問題:
(1)對青蒿進行干燥破碎的目的是_____________。
(2)操作I需要的玻璃儀器主要有:燒杯、_________,操作Ⅱ的名稱是_______________。
(3)操作Ⅲ的主要過程可能是_____________(填字母)。
A.加水溶解,蒸發濃縮、冷卻結晶
B.加95%的乙醇,濃縮、結晶、過濾
C.加入乙醚進行萃取分液
(4)用下列實驗裝置測定青蒿素分子式的方法如下:將28.2g青蒿素樣品放在硬質玻璃管C中,緩緩通入空氣數分鐘后,再充分燃燒,精確測定裝置E和F實驗前后的質量,根據所測數據計算。
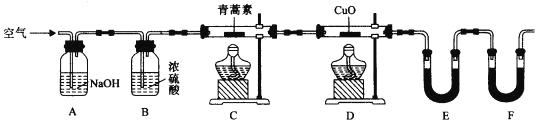
①裝置E中盛放的物質是______________,裝置F中盛放的物質是________________。
②該實驗裝置可能會產生誤差,造成測定含氧量偏低,改進方法是_______________。
③用合理改進后的裝置進行試驗,稱得:
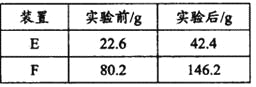
則測得青蒿素的最簡式是__________________。
(5)某學生對青蒿素的性質進行探究。將青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量較小,加熱并攪拌,青蒿素的溶解量增大,且溶液紅色變淺,說明青蒿素與____________(填字母)具有相同的性質。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小組經多次提取青蒿素實驗認為用石油醚做溶劑較為適宜,實驗中通過控制其他實驗條件不變,來研究原料的粒度、提取時間和提取溫度對青蒿素提取速率的影響,其結果如下圖所示:
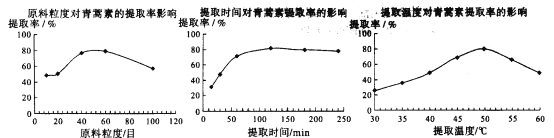
由上圖可知控制其他實驗條件不變,采用的最佳粒度、時間和溫度為_______________。
A.80目、100分鐘、50℃ B.60目、120分鐘、50℃ C.60目、120分鐘、55℃
查看答案和解析>>
科目: 來源: 題型:
【題目】氧化鋅為白色固體,可用于濕疹、癬等皮膚病的治療。純化工業級氧化鋅[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等雜質]的流程如下:

提示:在本實驗條件下,Ni(Ⅱ)不能被氧化;高錳酸鉀的還原產物是 MnO2。回答下列問題:
(1)為加快步驟①的浸取速率,下列措施中無法達到目的是_____(填字母)。
a.將樣品粉碎 b.延長浸取時間 c.充分攪拌
d.適當增加硫酸濃度 e.適當升高溫度
(2)反應②中除掉的雜質離子是_____(填離子符號),發生反應的離子方程式為:_____。
(3)加入高錳酸鉀溶液前,若 pH 較低,對除雜的影響是_____。
(4)步驟③過濾得到的濾渣中,除了過量的鋅外還有_____。
(5)反應④中產物的成分可能是 ZnCO3xZn(OH)2。取干燥后的濾餅 11.2 g,煅燒后可得到產品 8.1 g,則 x=_____(ZnCO3、Zn(OH)2 的相對分子質量分別為:125、99)。
查看答案和解析>>
科目: 來源: 題型:
【題目】圖1是元素周期表的一部分,表中所列的字母分別代表一種化學元素。
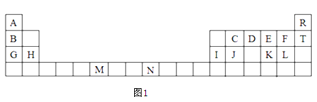
試回答下列問題:
(1)F-的結構示意圖:__。
(2)D的氣態氫化物的VSEPR模型為___,其中心原子的雜化類型為___,分子的空間構型為___。
(3)G、H和I的第一電離能數值由大到小的順序為:___(用元素符號作答)。
(4)元素M的化合物(MO2Cl2)在有機合成中可作氧化劑或氯化劑,能與許多有機物反應。請回答下列問題:
①與M同周期的所有元素的基態原子中最外層電子數與M原子相同的元素還有____(填元素符號)。
②MO2Cl2常溫下為深紅色液體,能與CCl4、CS2等互溶,據此可判斷MO2Cl2是___(填“極性”或“非極性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五種有機化合物中,碳原子采取sp2雜化的分子有___(填分子式)。
(5)已知元素N可形成一種紅紫色配合物,其組成為NCl3·5NH3·H2O。該配合物中的中心離子N離子在基態時核外簡化電子排布式為___,又已知中心離子N離子的配位數是6,1mol該物質與足量的硝酸銀反應可生成3molAgCl,則該物質的配體是___。
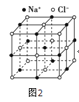
(6)過去常以JE2為催化劑的載體。JE2的晶胞可作如下推導:先將NaCl晶胞中的所有Na+去掉,并將Cl-全部換成J原子,再在每兩個不共面的“小立方體”中心處各放置一個J原子便構成了晶體J的一個晶胞,則一個J的晶胞中有___個J原子,再在每兩個相鄰的J原子(距離最近的兩個J原子)中心連線的中點處增添一個E原子,便構成了JE2晶胞,故JE2晶胞中有___個E原子。
查看答案和解析>>
科目: 來源: 題型:
【題目】X、Y、Z三種氣體都能對大氣造成污染,在工業上都可以用堿液吸收。已知X是化石燃料燃燒產物之一,是形成酸雨的主要物質;Y是一種單質,它的水溶液具有漂白作用;Z是硝酸工業和汽車尾氣中的有害物質之一,能與水反應。請寫出下列物質反應的化學方程式。
(1)X在一定條件下與氧氣反應____________________________________;
(2)Y與氫氧化鈉溶液的反應______________________________________;
(3)Z與水的反應________________________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某學生為探究鈉與二氧化碳的反應,利用如圖裝置進行實驗。
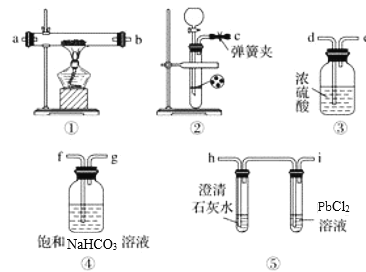
已知PdCl2能被一氧化碳還原得到黑色的Pd.請回答下列問題:
(1)請將如圖各裝置連接完整:c接f,_____接_____,_____接_____,_____接_____。
(2)若用稀鹽酸與碳酸鈣反應制備二氧化碳,在加稀鹽酸時,發現碳酸鈣與稀鹽酸不能接觸,而稀鹽酸又不夠了,為使反應能順利進行,可向長頸漏斗中加入的試劑是_____(填字母)。
A.硝酸鈉溶液 B.四氯化碳 C.苯 D.稀硝酸
(3)檢查裝置氣密性并裝好藥品后,點燃酒精燈之前應進行的操作是打開彈簧夾,讓二氧化碳充滿整個裝置,當觀察到_____時,再點燃酒精燈。此步操作的目的是_____________________。
(4)反應過程中二氧化碳足量,假如裝置⑤PdCl2溶液中觀察到有黑色沉淀,裝置①中固體成分只有一種,且向固體中加入稀鹽酸產生能使澄清石灰水變渾濁的氣體。寫出鈉與二氧化碳反應的化學方程式_______________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列敘述正確的是( )
A.FeO與稀硝酸反應屬于復分解反應
B.常溫下Fe與濃硝酸不反應
C.銅片與濃硝酸發生離子反應:Cu+NO3-+4H+=Cu2++NO2↑+2H2O
D.向Fe(NO3)2稀溶液中加入鹽酸發生反應:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】磁性材料A是由兩種元素組成的化合物,某研究小組按如圖流程探究其組成:
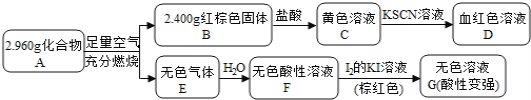
已知E是形成酸雨的主要氣體,請回答:
(1)A的組成元素為______(用化學符號表示);
(2)C溶液可溶解銅片,寫出該反應的離子方程式______________________________;
(3)寫出F→G反應的化學方程式_________________________________,設計實驗證明溶液G中含有![]() ____________________________________________________________________。
____________________________________________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】為了除去KCl溶液中少量的MgCl2、MgSO4,可選用Ba(OH)2、HCl和K2CO3三種試劑,按如下步驟操作:
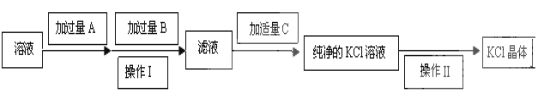
(1)寫出上述試劑的化學式:A_____________________。
(2)上述操作Ⅰ所用玻璃儀器的名稱是__________________;操作Ⅱ的名稱是_____________。
(3)加過量A時發生有關反應的離子反應方程式為:_________________、__________________。
(4)檢驗試劑B是否過量的方法:__________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com