
科目: 來源: 題型:
【題目】已知![]() 為
為![]() 和
和![]() 的混合物,且知氧化性順序:
的混合物,且知氧化性順序:![]() ,取
,取![]() 樣品進行如下圖所示的實驗:
樣品進行如下圖所示的實驗:

(1)寫出③步可能發生反應的3個離子方程式為________________________、________________________、________________________。
(2)若溶液E中只有一種金屬離子,則一定是______;若D固體是純凈物,該固體是______。(填化學式)
(3)向溶液A中加入![]() 粉,若會反應,則寫出反應的離子方程式,若不會反應,則填“不能”在橫線上__________________________________________。
粉,若會反應,則寫出反應的離子方程式,若不會反應,則填“不能”在橫線上__________________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】有效去除大氣中的NOx和SO2是環境保護的重要課題。
(1)酸性條件下,NaClO2吸收NO的相關熱化學方程式如下:
4NO(g) + 3NaClO2(aq) + 2H2O(l) = 4HNO3(aq) + 3NaCl(aq) ΔH= a kJ·mol1
5NaClO2(aq) + 4HCl(aq) = 4ClO2(g) + 2H2O(l) + 5NaCl(aq) ΔH= b kJ·mol1
反應5NO(g) + 3ClO2(g) + 4H2O(l) = 5HNO3(aq) + 3HCl(aq) ΔH=________kJ·mol1。
(2)用電解法處理氮氧化物可回收硝酸。實驗室模擬電解NO2的裝置如圖-1所示。寫出電解時陽極的電極反應式:________。
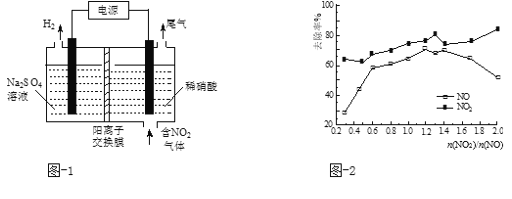
(3)用CO(NH2)2水溶液吸收SO2并通入O2,反應生成(NH4)2SO4和CO2。寫出該反應的化學方程式:___________。
(4)利用活性焦炭的吸附作用,可以對煙氣進行脫硫和脫硝。被吸附的NO2與活性焦炭反應生成N2和CO2,當生成1 mol N2時,轉移的電子數為_________mol。
(5)一定條件下,將一定濃度NOx(NO2和NO的混合氣體)通入0.05 mol·L1的Ca(OH)2乳濁液中,發生的反應為:3NO2 + 2OH-= NO +2NO3-+ H2O;NO + NO2 +2OH-= 2NO2- + H2O。改變![]() ,NOx的去除率見圖-2。
,NOx的去除率見圖-2。
①![]() 的合適范圍是___________________。
的合適范圍是___________________。
②當![]() 大于1.4時,NO2去除效率升高,但NO去除效率卻降低。其可能的原因是______ 。
大于1.4時,NO2去除效率升高,但NO去除效率卻降低。其可能的原因是______ 。
③O3和NO發生的主要反應為:NO + O3 = NO2 + O2。保持NO的初始濃度不變,改變![]() ,將反應后的混合氣體通入0.05mol·L1Ca(OH)2乳濁液中吸收。為節省O3的用量,又能保持NOx去除效果,則
,將反應后的混合氣體通入0.05mol·L1Ca(OH)2乳濁液中吸收。為節省O3的用量,又能保持NOx去除效果,則![]() 合適的值約為_________。
合適的值約為_________。
a.0.6 b.0.8 c.1.4
查看答案和解析>>
科目: 來源: 題型:
【題目】現有一定量含有Na2O雜質的Na2O2試樣,用如圖的實驗裝置測定Na2O2試樣的純度。
回答下列問題:

(1)裝置A中盛放稀鹽酸的儀器名稱為__________________。
(2)裝置B的作用是______________________________________。
(3)裝置C的作用是____________________________________________。
(4)裝置D中發生反應的化學方程式是_____________、_______________。
(5)裝置E中堿石灰的作用是______________________________________。
(6)若開始時稱得樣品的質量為4.52 g,反應結束后稱得固體的質量為6.36g,則Na2O2試樣的純度為____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】A、B、C、D、E、F六種元素,它們的相關信息如下:①原子序數依次增大,②A和C的L能層中都有兩個未成對的電子,③C、D同主族且位于相鄰周期,④E和F的原子序數相差3,F原子除最外能層只有1個電子外,其余各能層均全充滿。根據以上信息填空(涉及的具體物質用元素符號或化學式回答):
(2)基態D原子中,具有______種不同能量的電子,E2+的價層電子軌道表達式是______。
(2)六種元素中電負性最強的元素是______。
(3)A元素的最高價氧化物中心原子采取的軌道雜化方式為______,D元素的最簡單氫化物的VSEPR模型為______。
(4)與化合物AC2互為等電子體的分子的分子式為______(任寫一種,下同),與化合物AC2互為等電子體且含有的元素只能是上述六種元素中的一價陰離子為______。
(5)某種化合物由D、E、F三種元素組成,其晶胞結構如圖所示,則其化學式為______,該晶胞上下底面為正方形,側面與底面垂直,根據圖中所示的數據列式計算該晶體的密度:ρ=______g·cm-3(只要求列出計算式)。
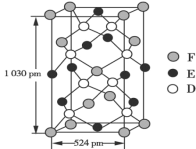
查看答案和解析>>
科目: 來源: 題型:
【題目】制備鈣摻雜納米Fe3O4,并模擬吸附廢水中磷元素的主要實驗流程如下:

已知:①CaO2能氧化溶液中的FeCl2,反應生成Fe(OH)3和Fe3+。
②摻雜的Ca2+嵌入Fe3O4中,洗滌時不損失,吸附時不形成Ca3(PO4)2等沉淀。
③溶液的pH對吸附劑表面所帶電荷有影響。pH越高,表面所帶負電荷越多; pH越低,表面所帶正電荷越多。
(1)向FeCl2、FeCl3混合溶液中滴加NaOH溶液,一定條件下反應生成Fe3O4,其離子方程式為___________。
(2)步驟Ⅱ調節pH至11,共沉淀需在70℃條件下進行,適宜的加熱方式為________。為提高共沉淀效果,還可采取的措施為_______________。
(3)磷元素的吸附效果、H3PO4水溶液中含磷物種分布分數與pH的關系分別如圖1和圖2所示。

①步驟Ⅳ用KH2PO4溶液模擬廢水,測得酸性條件下(pH > 2)對磷元素吸附量較大,原因是:pH越低,吸附劑表面所帶正電荷越多,有利于吸附陰離子;___________________
②步驟Ⅴ將吸附劑取出,用堿液解吸回收磷。結合表中數據,分析鈣摻雜納米Fe3O4吸附劑與其他類型吸附劑相比的優勢有:________。
不同類型吸附劑對磷酸鹽吸附能力比較
吸附劑 | 本產品 | 純Fe3O4 | 陶瓷材質 |
吸附量/mg·g-1 | 24.1 | 5.0 | 12.5 |
(4)請設計從步驟Ⅱ反應結束后的燒瓶中獲取鈣摻雜納米Fe3O4產品的實驗方案:用磁鐵將沉淀物和溶液分離,______________,用篩網篩分得到產品 (實驗中須使用的試劑和儀器有:蒸餾水、無水乙醇、pH計、研缽、烘箱)。
查看答案和解析>>
科目: 來源: 題型:
【題目】凈水劑能夠改善水質,給人們的生活、健康帶來很大的益處。
(1) 明礬[KAl(SO4)2·12H2O]是常見的凈水劑。其在水中的電離方程式為_______;明礬可凈水是因為在天然水中生成膠狀Al(OH)3,Al(OH)3具有____的作用。
(2)堿式氯化鋁(簡稱BAC)是高效凈水劑的主要成分。實驗室模擬利用鋁土礦(主要含Al2O3,還含少量Fe2O3及其他不溶雜質)制取堿式氯化鋁[Al2(OH)nCl6-n]的過程如下:

①鹽酸溶解鋁土礦過程中,發生反應的離子方程式為_____________、_______;溶解過程中需不斷攪拌,目的是________________。
②加適量鋁粉的主要作用是_______________。
③蒸發濃縮所需玻璃儀器為_______________。
查看答案和解析>>
科目: 來源: 題型:
【題目】蓮花清瘟膠囊對新冠肺炎輕癥狀患者有顯著療效,其有效成分綠原酸存在如圖轉化關系,下列有關說法正確的是
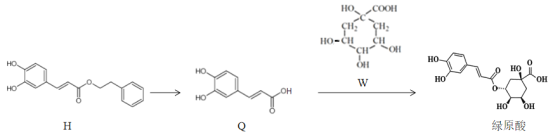
A.H的分子式為C17H14O4
B.Q中所有碳原子不可能都共面
C.1mol綠原酸與足量NaHCO3溶液反應,最多放出1molCO2
D.H、Q、W均能發生氧化反應、取代反應、顯色反應
查看答案和解析>>
科目: 來源: 題型:
【題目】為了探究鐵與氯氣的反應,某同學甲設計了如下的實驗方案及步驟。

實驗裝置圖
(1)用注射器吸取20 mL左右的________(填化學式)。
(2)按圖所示連接實驗裝置,并固定在鐵架臺上。經檢驗裝置不漏氣。在硬質玻璃管內加入一定量的細鐵絲,一支試管內加入硫氰化鉀溶液,另一支試管中加入氫氧化鈉溶液。
(3)加熱硬質玻璃管內鐵絲約1 min,然后把注射器中的氯氣注入到硬質玻璃管內,觀察實驗現象。硬質玻璃管內可觀察到產生__________色的煙,盛硫氰化鉀溶液的試管內顯____________。
(4)請寫出加入硫氰化鉀溶液試管中所發生反應的離子方程式:_____________________。其中,氫氧化鈉溶液的作用是______________。
(5)某同學取適量生成物溶于水得50.0mL溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。則溶液中c(Cl-)=__________mol·L-1。
查看答案和解析>>
科目: 來源: 題型:
【題目】A、X、Y、Z、Q、R、T 分別代表原子序數依次增大的短周期元素。元素A是原子半徑最小的元素;X、Y、Z同周期且相鄰,都是蛋白質的組成元素;X、R同族,Q與T原子的最外層電子數之和是R原子最外層電子數的2倍,T單質為淡黃色固體。U是d區元素,U2+的核外最高能級有2對成對電子。請回答下列問題:
(1)Y元素在周期表中的位置______,位于周期表______區;Q原子的核外電子排布式為______。
(2)X、Y、Z元素的第一電離能由大到小的順序是______。
(3)TZ3分子為______分子(填“極性”或“非極性”),YZ2–離子實際構型是______。
(4)Z和T的簡單氣態氫化物穩定性好的是______(填化學式),原因是______。
(5)A、X、Z可形成分子式為A2XZ的有機物,則該化合物分子中X原子的軌道雜化類型是______;1mol該分子中含有π鍵的數目是______。(用“NA”表示)
查看答案和解析>>
科目: 來源: 題型:
【題目】室溫下,向![]() 鹽酸中滴加
鹽酸中滴加![]() 溶液,溶液的pH隨
溶液,溶液的pH隨![]() 溶液體積的變化如圖。已知
溶液體積的變化如圖。已知![]() 。下列說法不正確的是( )
。下列說法不正確的是( )
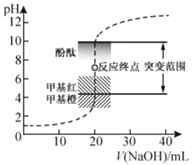
A.![]() 與鹽酸恰好完全反應時,
與鹽酸恰好完全反應時,![]()
B.選擇變色范圍在pH突變范圍內的指示劑,可減小實驗誤差
C.選擇甲基紅指示反應終點,誤差比甲基橙的大
D.![]() 時,
時,![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com