
科目: 來源: 題型:
【題目】(1)25 ℃時,制備亞硝酰氯所涉及的熱化學方程式和平衡常數如表:
熱化學方程式 | 平衡常數 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
則該溫度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
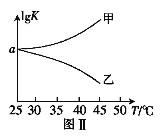
(2)25℃時,在體積為2L的恒容密閉容器中通入0.08 mol NO和0.04 molCl2發生上述反應③,若反應開始與結束時溫度相同,數字壓強儀顯示反應過程中壓強(p)隨時間(t)的變化如圖Ⅰ實線所示,則ΔH3 ___(填“>”“<”或“=”)0;若其他條件相同,僅改變某一條件,測得其壓強隨時間的變化如圖Ⅰ虛線所示,則改變的條件是_____________;在5 min時,再充入0.08 mol NO和0.04 molCl2,則混合氣體的平均相對分子質量將_____________(填“增大”、“減小”或“不變”)。圖Ⅱ是甲、乙兩同學描繪上述反應③的平衡常數的對數值(lgK)與溫度的變化關系圖,其中正確的曲線是______(填“甲”或“乙”),a值為__________。25 ℃時測得反應③在某時刻,NO(g)、Cl2(g)、NOCl(g)的濃度分別為0.8、0.1、0.3,則此時v正_________v逆(填“>”“<”或“=”)

(3)在300 ℃、8 MPa下,將CO2和H2按物質的量之比1∶3 通入一密閉容器中發生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反應,達到平衡時,測得CO2的平衡轉化率為50%,則該反應條件下的平衡常數為Kp=_____(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
CH3OH(g)+H2O(g)中反應,達到平衡時,測得CO2的平衡轉化率為50%,則該反應條件下的平衡常數為Kp=_____(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知反應①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反應②H2(g)+CuO(s)
CO2(g)+Cu(s)和反應②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某溫度下的平衡常數分別為K1和K2,該溫度下反應③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某溫度下的平衡常數分別為K1和K2,該溫度下反應③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常數為K。則下列說法正確的是( )
CO2(g)+H2(g)的平衡常數為K。則下列說法正確的是( )
A. 反應①的平衡常數K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反應③的平衡常數K=K1/K2
C. 對于反應③,恒容時,溫度升高,H2濃度減小,則該反應的焓變為正值
D. 對于反應③,恒溫恒容下,增大壓強,H2濃度一定減小
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)烷烴A的碳原子數是5,則符合A的結構有____________ 種,其中含有四個甲基的系統命名為________________________________ ;
(2)烷烴B在同溫同壓下蒸氣的密度是H2的43倍,則B的分子式為____________,其中含有3個-CH3的同分異構體的結構簡式為___________________________、________________________________;
(3)某氣態烴在標準狀況下的密度為2.59g/L,該烴的含碳量為82.8%,則分子中碳、氫原子的個數比是______________,分子式是_________________;
查看答案和解析>>
科目: 來源: 題型:
【題目】某無色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等離子中的幾種,當向該溶液中加入某濃度的NaOH溶液時,發現生成沉淀的物質的量隨NaOH溶液的體積變化如圖所示。下列說法一定正確的是( )

A.一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42-、Fe3+
B.一定存在H+、Al3+、NH4+、SO42-,可能存在Na+、Mg2+
C.溶液中c(H+):c(Al3+):c(Mg2+)=1:1:2
D.溶液中c(H+)/c(SO42-)![]() 2/9
2/9
查看答案和解析>>
科目: 來源: 題型:
【題目】一定溫度下,對可逆反應A(g)+2B(g)3C(g)的下列敘述中,能說明反應已達到平衡的是( )
A.單位時間內消耗amolA,同時生成3amolCB.C的生成速率與C分解的速率相等
C.容器內壓強不再變化D.混合氣體的物質的量不再變化
查看答案和解析>>
科目: 來源: 題型:
【題目】某鋁合金(硬鋁)中含有鎂、銅、硅,為了測定該合金中鋁的含量,有人設計如下實驗:
(1)稱取樣品ag。
(2)將樣品溶于足量稀鹽酸中,過濾,濾液中主要含有___離子,濾渣中含有___;在溶解過濾時使用的儀器有___。
(3)往濾液中加入過量NaOH溶液,過濾,寫出該步操作中有關的離子方程式____。
(4)在第(3)步的濾液中通入足量CO2過濾,將沉淀用蒸餾水洗滌數次后,烘干并灼燒至質量不再減少為止,冷卻后稱量,質量為bg。有關反應的化學方程式為____。
(5)計算該樣品中鋁的質量分數的表達式為___。
(6)若第(3)步中加入NaOH溶液的量不足時,會使測定的結果___(“偏高”“偏低”或“無影響”,下同)。若第(4)步對沉淀的灼燒不充分時,會使測定的結果___。若第(4)步中的沉淀沒有用蒸餾水洗滌時,會使測定的結果____。
查看答案和解析>>
科目: 來源: 題型:
【題目】電子工業常用30%的FeCl3溶液腐蝕敷在絕緣板上的銅箔,制造印刷電路板。
(1)檢驗溶液中Fe3+存在的常用試劑是___,證明Fe3+存在的現象是____,配制含Fe2+的溶液時,常常向溶液中加入少量___,使被氧氣氧化形成的Fe3+還原為Fe2+。
(2)寫出FeCl3溶液與金屬銅發生反應的化學方程式:___。
(3)某工程師為了從使用過的腐蝕廢液中回收銅,并重新獲得FeCl3溶液,準備采用下列步驟:

A.請寫出上述實驗中加入或生成的有關物質的化學式。
①___,②___,③___,④____,⑤____,⑥_____。
B.請寫出相關反應的化學方程式。_______。
查看答案和解析>>
科目: 來源: 題型:
【題目】閱讀下列材料后,回答相應問題。
鐵在人體中以Fe2+和Fe3+的形式存在。二價鐵離子易被吸收,給貧血者補充鐵時,應給予含二價鐵離子的鐵鹽,如硫酸亞鐵(FeSO4)。
(1)人體中經常進行轉化Fe2+![]() Fe3+,A反應中Fe2+作__劑,B反應中Fe3+作__劑,服用維生素C,可使食物中的三價鐵離子還原成二價鐵離子,有利于鐵的吸收。這說明維生素C具有__性。
Fe3+,A反應中Fe2+作__劑,B反應中Fe3+作__劑,服用維生素C,可使食物中的三價鐵離子還原成二價鐵離子,有利于鐵的吸收。這說明維生素C具有__性。
(2)新配制的FeCl2溶液應加入__以防止FeCl2轉化為FeCl3,要除去FeCl3溶液中少量的FeCl2雜質,可向其中通入適量的__。
(3)為除去廢水中的Fe2+,常先將廢水中的Fe2+氧化為__(用離子符號表示),再__使Fe3+轉化為紅褐色的__(用化學式表示)沉淀析出。
(4)在制作印刷電路板的過程中常利用銅與氯化鐵溶液的反應。反應的離子方程式為__。
(5)為消除廢氣中的Cl2對環境的污染,將廢氣通過含有鐵粉的FeCl2溶液,即可有效地除去Cl2,這一處理過程可用兩個離子方程式表示為__,__;處理過程中需定期添加的原料是__。
(6)某同學為檢驗某未知溶液中是否為FeCl2溶液,采取如下實驗方案加以驗證:取少許未知試液于試管中![]()
![]() 溶液呈紅色(證明含有FeCl2),你認為此方案__(填“合理”或“不合理”),若不合理,如何改進:__。
溶液呈紅色(證明含有FeCl2),你認為此方案__(填“合理”或“不合理”),若不合理,如何改進:__。
查看答案和解析>>
科目: 來源: 題型:
【題目】己烯雌酚(結構簡式如圖所示》,是一種激素類藥物。下列敘述正確的是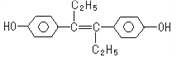
A. 己烯雌酚分子式為C18H12O2
B. 己烯雌酚與NaOH溶液、NaHCO3溶液均能反應
C. 1mol己烯雌酚最多能與4mol溴發生反應
D. 己烯雌酚可以發生加成反應,取代反應、氧化反應
查看答案和解析>>
科目: 來源: 題型:
【題目】利用如圖所示裝置進行下列實驗,能得出相應實驗結論的是( )

選項 | ① | ② | ③ | 實驗結論 |
A | 稀鹽酸 | CaCO3 | Na2SiO3溶液 | 非金屬性:Cl>C>Si |
B | 濃硫酸 | 蔗糖 | Ba(NO3)2溶液 | 驗證SO2與可溶性鋇鹽可生成白色沉淀 |
C | 濃氨水 | 生石灰 | 酚酞溶液 | 氨氣的水溶液呈堿性 |
D | 濃硝酸 | Fe | NaOH溶液 | 鐵和濃硝酸反應可生成NO2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com