
科目: 來源: 題型:
【題目】隨著現代科學技術的快速發展,防腐蝕技術也在不斷提高。
Ⅰ.金屬的腐蝕原理
(1)中性環境中多為吸氧腐蝕,其正極的電極反應為________。
(2)析氫腐蝕和吸氧腐蝕的均會導致體系中c(OH-)________(填“增大”、“不變”或“減小”)。
(3)不同酸性介質中,金屬腐蝕原理并不相同。下圖是密閉容器中,生鐵在pH=2和pH=4的鹽酸中壓強隨時間的變化過程。
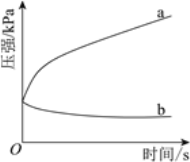
圖中代表pH=2的曲線是________(填“a”或“b”)。
Ⅱ.金屬的電化學防護
(1) 富鋅涂料是使用廣泛的防銹底漆,涂層中鋅對鋼鐵保護的原理是________。
(2) 緩蝕劑是能明顯減緩或阻止金屬腐蝕的物質,鉬酸鈉(Na2MoO4)和磷酸二氫鋅[Zn(H2PO4)]2是常用自來水(pH范圍6.5~8.8)介質碳鋼緩蝕劑。
①鉬酸鈉(Na2MoO4)在電極表面被還原為MoO2形成保護膜,減緩腐蝕,該電極反應為______;同時,MoO42-能與Fe2+反應生成難溶的Fe2O3和MoO2,沉積在碳鋼表面減緩腐蝕。寫出MoO42-與Fe2+反應的離子反應方程式:_______。
②電化學反應可使緩蝕劑成分中的Zn(H2PO4)2轉化為難溶性的Zn3(PO4)2,形成保護膜,減緩腐蝕。用平衡移動原理解釋發生轉化原因________。
查看答案和解析>>
科目: 來源: 題型:
【題目】已如反應:CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g) +HCl(g)。在一定壓強下,按ω=
CH2=CHCH2Cl(g) +HCl(g)。在一定壓強下,按ω=![]() 向密閉容器中充入氯氣與丙烯。圖甲表示平衡時,丙烯的體積分數(φ) 與溫度(T)、ω 的關系,圖乙表示逆反應的平衡常數與溫度的關系。則下列說法錯誤的是
向密閉容器中充入氯氣與丙烯。圖甲表示平衡時,丙烯的體積分數(φ) 與溫度(T)、ω 的關系,圖乙表示逆反應的平衡常數與溫度的關系。則下列說法錯誤的是

A. 圖甲中,ω2>1
B. 圖乙中,A線表示逆反應的平衡常數
C. 溫度T1、ω=2時,Cl2的轉化率為50%
D. 若在恒容絕熱裝置中進行上述反應,達到平衡時,裝置內的氣體壓強將增大
查看答案和解析>>
科目: 來源: 題型:
【題目】某小組以4H++4I-+O2=2I2+2H2O為研究對象,探究影響氧化還原反應因素。
實驗 | 氣體a | 編號及現象 |
| HCl | Ⅰ.溶液迅速呈黃色 |
SO2 | Ⅱ.溶液較快呈亮黃色 | |
CO2 | Ⅲ.長時間后,溶液呈很淺的黃色 | |
空氣 | Ⅳ.長時間后,溶液無明顯變化 |
(1)實驗Ⅳ的作用是______________。用CCl4萃取Ⅰ、Ⅱ、Ⅲ、Ⅳ的溶液,萃取后下層CCl4的顏色均無明顯變化。
(2)取萃取后上層溶液,用淀粉檢驗:Ⅰ、Ⅲ的溶液變藍;Ⅱ、Ⅳ的溶液未變藍。溶液變藍說明Ⅰ、Ⅲ中生成了______________。
(3)查閱資料:I2易溶于KI溶液。下列實驗證實了該結論并解釋Ⅰ、Ⅲ的萃取現象。
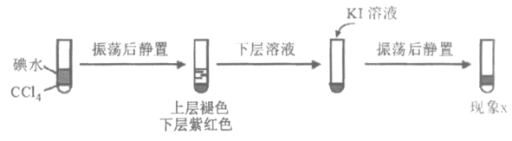
現象x是______________。
(4)針對Ⅱ中溶液未檢出I2的原因,提出三種假設:
假設1:溶液中c(H+)較小。小組同學認為此假設不成立,依據是______________。
假設2:O2只氧化了SO2,化學方程式是______________。
假設3:I2不能在此溶液中存在。
(5)設計下列實驗,驗證了假設3,并繼續探究影響氧化還原反應的因素。
i.取Ⅱ中亮黃色溶液,滴入品紅,紅色褪去。
ii.取Ⅱ中亮黃色溶液,加熱,黃色褪去,經品紅檢驗無SO2。加入酸化的AgNO3溶液,產生大量AgI沉淀,長時間靜置,沉淀無明顯變化。
iii.取Ⅱ中亮黃色溶液,控制一定電壓和時間進行電解,結果如下。
電解時間/min | 溶液 | 陽極 | 陰極 |
t1 | 黃色變淺、有少量SO42- | 檢出I2,振蕩后消失 | H2 |
| 溶液無色、有大量SO42- | 檢出I2,振蕩后消失 | H2 |
結合化學反應,解釋上表中的現象:______________。
(6)綜合實驗證據說明影響I-被氧化的因素及對應關系______________。
查看答案和解析>>
科目: 來源: 題型:
【題目】現有100mLMgCl2和AlCl3的混合溶液其中c(Mg2+)=2molL-1,c(Cl-)=7molL-1,要使鎂離子轉化成Mg(OH)2并使Mg2+和Al3+分離開來,至少需要4molL-1的NaOH溶液
A.140 mL B.120 mL C.200 mL D.80 mL
查看答案和解析>>
科目: 來源: 題型:
【題目】利用下圖,可以從不同角度研究含氯物質的性質及其轉化關系,圖中甲~辛均含氯元素。回答下列問題:

(1)丙的化學式為_______;從組成和性質上分析,丁屬于_______(填“酸性”或“堿性”)氧化物。
(2)圖中甲、乙、丁、戊中,屬于電解質的是__________(填化學式);根據氯元素的化合價判斷,乙物質__________。
a 只有氧化性 b 既有氧化性又有還原性
c 只有還原性 d 既能做氧化劑也能做還原劑
(3)電解甲溶液制備己的化學反應為:甲+ H2O→己+H2↑,反應中甲與H2O的物質的量之比是______。
(4)庚是漂白粉的有效成分,用乙制取庚的化學反應方程式為_________。
(5)辛在MnO2催化下受熱分解可用于制備一種常見氣體,這種氣體的化學式是____。
查看答案和解析>>
科目: 來源: 題型:
【題目】甲、乙兩同學分別設計實驗,測定CO2與Na2O2反應后的殘留物(成分為Na2O2、Na2CO3及少量不溶性雜質)中Na2O2的質量分數。
(1)甲同學設計的實驗流程如下:
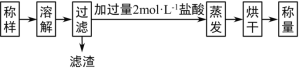
①試樣溶解過程中發生反應的化學方程式為_______。
②實驗中用12 molL-1鹽酸配制2molL-1鹽酸500mL,配制過程中用到的儀器有燒杯、玻璃棒、_____、______、_______,定容時俯視刻度線會使所配溶液濃度_____(填“偏高”“偏低”或“無影響”)。
③稱取試樣5.12 g,得濾渣0.10g,烘干得固體5.85g,則試樣中Na2O2的質量分數為___________%(保留1位小數)。
(2)乙同學利用如圖所示裝置進行實驗。

①實驗中應選取的試劑是_______________。
a 稀鹽酸 b 二氧化錳 c 蒸餾水 d 碳酸鈣
②裝置的連接順序應是_______________________(填各接口的字母,連接膠管略)。
查看答案和解析>>
科目: 來源: 題型:
【題目】t℃時,在體積不變的密閉容器中發生反應:X(g)+3Y(g)![]() 2Z(g),各組分在不同時刻的濃度如下表:下列說法正確的是( )
2Z(g),各組分在不同時刻的濃度如下表:下列說法正確的是( )
物質 | X | Y | Z |
初始濃度(mol/L) | 0.1 | 0.2 | 0 |
2min末濃度(mol/L) | 0.08 | a | b |
平衡濃度(mol/L) | 0.05 | 0.05 | 0.1 |
A.平衡時,X的轉化率為20%
B.t℃時,2min末Y與Z的物質的量濃度:a=0.06mol/L,b=0.4mol/L
C.增大平衡后的體系壓強,v正增大,v逆減小,平衡向正反應方向移動
D.前2min內,用Y的變化量表示的平均反應速率v(Y)=0.03mol/(L·min)
查看答案和解析>>
科目: 來源: 題型:
【題目】海洋約占地球表面積的71%,海水資源的利用前景廣闊,從海水中提取鎂的主要步驟如圖所示,下列說法正確的是
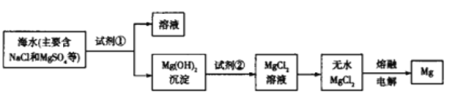
A.工業上利用NaOH溶液使Mg2+轉化為Mg(OH)2
B.與Mg同周期的金屬都可以采用電解熔融的無水氯化物來制備
C.試劑②可以選用鹽酸
D.工業上也可以將Mg(OH)2煅燒分解為MgO,通過電解熔融MgO制取Mg
查看答案和解析>>
科目: 來源: 題型:
【題目】在一定溫度下,冰醋酸加水稀釋過程中,溶液的導電能力如圖。

(1)O點導電能力為零的理由: 。
(2)a、b、c三點酸性由大到小的順序為 。
(3)若使c點溶液中的c(CH3COO-)提高,在如下措施中,可選 。
A.加熱
B.加很稀的NaOH溶液
C.加固體KOH
D.加水
E.加固體CH3COONa
F.加Zn粒
(4)在稀釋過程中,隨著醋酸濃度的降低,下列始終保持增大趨勢的量是 。
A.c(H+) B.H+個數
C.CH3COOH分子數 D.c(H+)/c(CH3COOH)
查看答案和解析>>
科目: 來源: 題型:
【題目】恒溫恒容條件下,發生反應:3A(g)+B(g)![]() 2C(g)△H=-QkJ/mol在3個密閉容器中,按下列方式投入反應物:
2C(g)△H=-QkJ/mol在3個密閉容器中,按下列方式投入反應物:
Ⅰ.3molA,1molB;Ⅱ.6molA,2molB;Ⅲ.4molC
則在保持恒溫恒容反應達到平衡時,下列選項正確的是( )
A.容器Ⅰ與容器Ⅱ中,C的濃度2cⅠ<cⅡ,平衡常數KⅠ=KⅡ,轉化率aⅠ>aⅡ
B.容器Ⅰ與容器Ⅲ中,B的體積分數vⅠ%>vⅢ%,反應的能量變化2QⅠ=QⅢ,平衡常數KⅠ2=![]()
C.容器Ⅱ與容器Ⅲ為等效平衡,B的體積分數VⅡ%=VⅢ%,轉化率aⅢ+aⅡ=1,反應的能量變化QⅡ+QⅢ=Q
D.容器Ⅰ容器Ⅱ容器Ⅲ中,平衡常數關系為:KⅠ2=KⅡ=![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com