
科目: 來源: 題型:
【題目】能源是人類生活和社會發展的基礎,研究化學反應中的能量變化,有助于更好地利用化學反應為生產和生活服務。
(1)CH4既是一種重要的能源,也是一種重要的化工原料。已知 8.0 g CH4完全燃燒生成液態水放出445.15 kJ熱量,則其熱化學方程式為_____。
(2)在一定溫度和催化劑作用下,CH4與CO2可直接轉化成乙酸,這是實現“減排”的一種研究方向。
①在不同溫度下,催化劑的催化效率與乙酸的生成速率如圖所示,則該反應的最佳溫度應控制在_____左右。
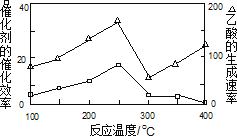
②該反應催化劑的有效成分為偏鋁酸亞銅(CuAlO2,難溶物)。將CuAlO2溶解在稀硝酸中生成兩種鹽并放出NO氣體,其離子方程式為_____。
③CH4 還原法是處理NOx氣體的一種方法。已知一定條件下CH4與NOx反應轉化為 N2和O2,若標準狀況下8.96 L CH4可處理22.4 L NOx,則x值為_____。
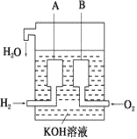
(3)美國阿波羅宇宙飛船上使用了一種新型電池裝置,其構造如下圖所示,A、B兩個電極均由多孔的炭塊組成。該電池的負極反應式為:_____。
若該電池工作時增加了1 mol H2O,電路中轉移電子的物質的量為_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】鋰離子電池應用很廣。某種鋰離子二次電池的電極材料主要是鈷酸鋰(LiCoO2)和石墨。鈷是一種稀有的貴重金屬,廢舊鋰離子電池電極材料的回收再生意義重大。
(1)鋰離子電池(又稱鋰離子濃差電池)的充電過程:Li+從含LiCoO2的電極中脫出,正三價Co被氧化,此時該極處于貧鋰態(Li1-xCoO2)。
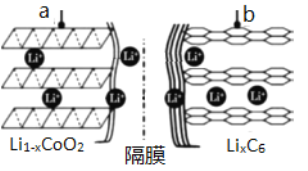
①充電時,a極的電極反應式為____________________________________。
②放電時,電流從______(填“a”或“b”)極流出。
(2)鈷酸鋰回收再生流程如下:

①H2SO4酸浸時,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是_______________。
②用鹽酸代替H2SO4和H2O2,浸出效率也很高,但工業上不使用鹽酸,主要原因之一是:會產生有毒、有污染的氣體。寫出相應反應的化學方程式______________________________。
③高溫下,在O2存在時純凈的CoC2O4與Li2CO3再生為LiCoO2的化學方程式為_______________。
(3)已知下列熱化學方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
寫出FeO(s)被CO還原成Fe和CO2的熱化學方程式_____________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】FeCl2具有獨有的脫色能力,適用于印染、造紙行業的污水處理。FeCl3在加熱條件下遇水劇烈水解。FeCl3和FeCl2均不溶于C6H5Cl、C6H4Cl2、苯。回答下列問題:
(1)由FeCl3.6H2O制得干燥FeCl2的過程如下:
i.向盛有FeCl3.6H2O的容器中加入過量SOCl2(液體,易水解),加熱,獲得無水FeCl3。
ii.將無水FeCl3置于反應管中,通入一段時間的氫氣后再加熱,生成FeCl2。
①FeCl3.6H2O中加入SOCl2獲得無水FeCl3的化學方程式為__________________。(已知該反應為非氧化還原反應)
②使用NH4SCN可以檢驗 ii中FeCl3是否含完全轉化,請寫出離子反應方程式_____________。
(2)利用反應2FeCl3 + C6H5Cl ![]() 2FeCl2+ C6H4Cl2 +HCl↑,制取無水FeCl2。在三頸燒瓶中加入無水氯化鐵和過量的氯苯,控制反應溫度在一定范圍內加熱3 h,冷卻、分離、提純得到粗產品,實驗裝置如圖。(加熱裝置略去)
2FeCl2+ C6H4Cl2 +HCl↑,制取無水FeCl2。在三頸燒瓶中加入無水氯化鐵和過量的氯苯,控制反應溫度在一定范圍內加熱3 h,冷卻、分離、提純得到粗產品,實驗裝置如圖。(加熱裝置略去)

①儀器B的名稱是_________ ;C的試劑名稱是________。
②反應結束后,冷卻實驗裝置A,將三頸燒瓶內物質倒出,經______、_______、干燥后,得到FeCl2粗產品。
③該裝置存在的不足之處是__________________________。
(3)粗產品中FeCl2的純度測定。
①取a g粗產品配制成100 mL溶液;②用移液管移取所配溶液5.00mL,放入500 mL錐形瓶內并加水至體積為200mL;③用0.100 mol·L-1酸性KMnO4標準溶液滴定,終點時消耗酸性KMnO4標準溶液V mL。若已知消耗酸性高錳酸鉀溶液為VmL,所配溶液的密度ρ(FeCl2)=kV ,密度的單位為g·L-1,則k=___________g·L-1·mL-1。
查看答案和解析>>
科目: 來源: 題型:
【題目】A、B、C、D、E、F、G七種短周期主族元素,它們的原子序數依次增大。A 有一種原子,中子數為零。B 原子的最外層電子數是電子層數的2倍。D元素原子的最外層電子數是次外層電子數的 3 倍。E元素的一種氧化物顏色為淡黃色。F與D同主族。請回答下列問題:
(1)B元素在周期表中的位置是_____,G的離子結構示意圖為_____。
(2)F與G最高價氧化物的水化物的酸性強弱為_________>_________(填化學式)。
(3)簡單D離子和E離子的半徑大小關系為_____>_________(填離子符號)。
(4) B和D簡單氣態氫化物的穩定性強弱為_____<_____(填化學式)
(5) F的一種氧化物中氧的質量分數為50%,寫出該氧化物與G單質水溶液反應的化學方程式:___________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】有機物M 的結構簡式如下:下列有關M 敘述不正確的是( )
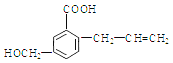
A. M的分子式為C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定條件下,M能生成高分子化合物
D. 能發生加成反應不能發生取代反應
【答案】D
【解析】
試題A.根據物質的結構簡式可知M的分子式是C11H12O3,正確; B.該物質的分子中含有碳碳雙鍵,因此能使溴的四氯化碳溶液褪色,正確;C. 該物質的分子中含有碳碳雙鍵,在一定條件下發生加聚反應形成高聚物,正確;D. 化合物M含有碳碳雙鍵,因此能發生加成反應,含有醇羥基、羧基,因此可以發生取代反應,錯誤。
考點:考查有機物的結構與性質的關系的知識。
【題型】單選題
【結束】
22
【題目】下列有關金屬腐蝕與防護的說法不正確的是( )
A. 鋼鐵發生電化學腐蝕時,若表面水膜呈中性,則正極發生的反應為:2H2O+O2+4e一= 4OH一
B. 在潮濕的空氣中,黃銅(銅鋅合金)制品比純銅制品更易產生銅綠
C. 金屬制品在海水中比淡水中更容易發生腐蝕
D. 從本質上看,金屬腐蝕是金屬原子失去電子變成陽離子被氧化的過程
【答案】B
【解析】A、鋼鐵發生電化學腐蝕時,若表面水膜呈中性發生吸氧腐蝕,則正極發生的反應為:2H2O+O2+4e一=4OH一,A正確;B、在潮濕的空氣中易發生電化學腐蝕,鋅的金屬性強于銅,因此黃銅(銅鋅合金)制品比純銅制品更不易產生銅綠,B錯誤;C、海水中含電解質濃度大,淡水中含電解質濃度小,故金屬制品在海水中比淡水中更容易發生腐蝕,C正確;D、從本質上看,金屬腐蝕是金屬原子失去電子變成陽離子被氧化的過程,D正確;答案選B。
【題型】單選題
【結束】
23
【題目】下列說法不正確的是
A. 麥芽糖及其水解產物均能發生銀鏡反應
B. 用溴水即可鑒別苯酚溶液,2,4-已二烯和甲苯
C. 在酸性條件下,![]() 的水解產物是
的水解產物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 縮合最多可形成4種二肽
縮合最多可形成4種二肽
查看答案和解析>>
科目: 來源: 題型:
【題目】某品牌的家用消毒劑其有效成分為對氯間二甲苯酚(結構簡式如下圖所示),可以殺滅常見的病毒與細菌。下面有關該物質的說法正確的是

A. 該物質的分子式是C8H10ClO
B. 1mol該物質最多可以與2mol NaOH反應
C. 1mol該物質可以與2mol液溴發生取代反應
D. 該物質可以發生加成、取代、消去、氧化等反應
查看答案和解析>>
科目: 來源: 題型:
【題目】我國秦俑彩繪和漢代器物上用的顏料被稱為“中國藍”、“中國紫”,直到近年來人們才研究出來其成分BaCuSi4O10,BaCuSi2O6。
(1)“中國藍”、“中國紫”中均具有Cun+離子,n=___。
(2)在5500年前,古代埃及人就己經知道如何合成藍色顏料—“埃及藍”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中國藍”一致。CO32一中鍵角∠OCO為___。根據所學,從原料分解的角度判斷“埃及藍”的合成溫度比“中國藍”更___(填“高”或“低”)。
(3)CaCux合金可看作由如圖所示的(a)、(b)兩種原子層交替堆積排列而成。(a)是由Cu和Ca共同組成的層,層中Cu—Cu之間由實線相連;(b)是完全由Cu原子組成的層,Cu—Cu之間也由實線相連。圖中虛線構建的六邊形,表示由這兩種層平行堆積時垂直于層的相對位置;(c)是由(a)和(b)兩種原子層交替堆積成CaCux合金的晶體結構圖。在這種結構中,同一層的Ca—Cu距離為294pm,相鄰兩層的Ca—Cu距離為327pm。
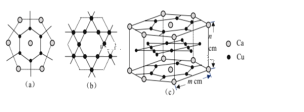
①該晶胞中Ca有___個Cu原子配位(不一定要等距最近)。
②同一層中,Ca原子之間的最短距離是______pm,設NA為阿伏加德羅常數的值,CaCux晶體的密度是_____g/cm3(用含m、n的式子表示)。
查看答案和解析>>
科目: 來源: 題型:
【題目】A、B、C、D、E五種物質之間的相互轉換關系如圖所示。已知:A為單質,可用于制造計算機芯片,E為無色有毒氣體。
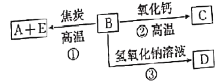
回答下列問題:
(1)B在物質分類上屬于___(填“酸性氧化物”或“堿性氧化物”)。
(2)反應①的化學方程式為___。
(3)反應②的化學方程式為___。
(4)在D的溶液中通入過量CO2氣體的離子方程式為___。
查看答案和解析>>
科目: 來源: 題型:
【題目】有5種元素X、Y、Z、Q、T。X原子最外層M層上有2個未成對電子且無空軌道;Y原子的價電子構型為3d64s2;Z原子的L電子層的p能級上有一個空軌道;Q原子的L電子層的p能級上只有一對成對電子;T原子的M電子層上p軌道半充滿。下列敘述不正確的是( )
A.元素Y和Q可形成化合物Y2O3
B.T的一種單質的空間構型為正四面體形,鍵角為![]()
C.X和Q結合生成的化合物為共價化合物
D.ZO2是極性鍵構成的非極性分子
查看答案和解析>>
科目: 來源: 題型:
【題目】聚合物H(![]() )是一種聚酰胺纖維,廣泛用于各種剎車片,其合成路線如圖:
)是一種聚酰胺纖維,廣泛用于各種剎車片,其合成路線如圖:
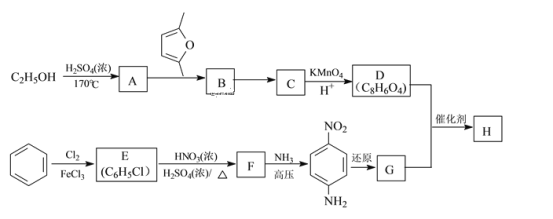
已知:①C、D、G均為芳香族化合物,分子中均只含兩種不同化學環境的氫原子
②Diels-Alder反應:![]() +
+![]()
![]()
![]()
③RCOOH+H2N-R'→RCOONHR'+H2O
(1)生成D的名稱是_______。
(2)B的結構簡式是_______;“B→C”的反應中,除C外,另外一種產物是_______。
(3)D+G→H的化學方程式是______。
(4)Q是D的同系物,相對分子質量比D大14,則Q可能的結構有______種,其中核磁共振氫譜有4組峰,且峰面積比為1:2:2:3的結構簡式為______。(任寫一種)。
(5)已知:乙炔與1,3-丁二烯也能發生Diels-Alder反應。請以1,3-丁二烯和乙炔為原料,選用必要的無機試劑合成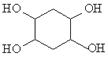 ,寫出合成路線______。(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
,寫出合成路線______。(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com