
科目: 來源: 題型:
【題目】從古至今,鐵及其化合物在人類的生產生活中都起了巨大的作用。
(1)古代中國四大發明之一的指南針是由天然磁石制成的,其主要成分是________。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在現代工業生產中,常利用 FeCl3 腐蝕銅的原理制作印刷線路板,寫出該原理的化學方程式_________________________
(3)實驗室在配制 FeSO4 溶液時為了防止 FeSO4 溶液變質,經常向其中加入鐵粉,其原因是_______________(用離子方程式表示) 。
(4)現有配制所得的 100mL 6mol/L FeSO4 溶液,往其中滴入一定量的稀硝酸,回答下列問題:
①配平該反應的離子方程式:□Fe2++□NO3-+□H+ = □Fe3++□NO↑+□H2O___________
②要檢驗該反應后的溶液中是否還含有 Fe2+,可選用的試劑為___________
A. 酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③經檢驗,上述反應后的溶液中不存在 Fe2+,則該反應過程中產生的 NO 體積為(標準狀況下)_____________L。
查看答案和解析>>
科目: 來源: 題型:
【題目】將0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀鹽酸。下列圖像能正確表示加入鹽酸的體積和生成CO2的物質的量的關系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目: 來源: 題型:
【題目】某化學小組以鋁土礦(含 Al2O3、Fe2O3和 SiO2)為原料進行煉鋁探究(流程如下),敘述錯誤的是
![]()
A. 步驟①②過程中均需過濾操作
B. a、b中鋁元素的化合價相同
C. 反應③的化學方程式為:2 NaAlO2+3H2O+CO2 = 2Al(OH)3↓+Na2CO3
D. d只能是氧化鋁
查看答案和解析>>
科目: 來源: 題型:
【題目】下列說法或有關化學用語的表達正確的是( )
A. 在基態多電子原子中,p軌道電子能量一定高于s軌道電子能量
B. 因氧元素電負性比氮元素大,故氧原子第一電離能比氮原子第一電離能大
C. 基態Fe原子的外圍電子排布圖為![]()
D. 根據原子核外電子排布的特點,Cu在元素周期表中位于s區
查看答案和解析>>
科目: 來源: 題型:
【題目】由氧化銅、氧化鐵、氧化鋅組成的混合物ag,加入2mol/L硫酸50mL時固體恰好完全溶解,若將ag該混合物在足量的一氧化碳中加熱充分反應,冷卻后剩余固體的質量為
A.1.6gB.(a-1.6)gC.(a-3.2)gD.無法確定
查看答案和解析>>
科目: 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列說法正確的是
A.常溫下lLpH=7的lmol/LCH3COONH4溶液中CH3COO-與![]() 數目均為NA
數目均為NA
B.162g聚合度為n的纖維素,含有羥基的數目為3nNA個
C.標準狀態下,22.4LCl2完全溶于水后,有Cl2、HClO、ClO-的總數目為NA
D.標準狀態下,lL苯完全燃燒生成的氣態產物的分子數為![]() NA
NA
查看答案和解析>>
科目: 來源: 題型:
【題目】一定條件下自然界存在如下反應:14CuSO4+5FeS2+l2H2O=7Cu2S+5FeSO4+12H2SO4,下列說法中不正確的是
A.Cu2S既是氧化產物又是還原產物
B.5molFeS2發生反應,有21mole—轉移
C.CuSO4和FeS2是氧化劑,FeS2是還原劑
D.產物中的SO42—有一部分是氧化產物
查看答案和解析>>
科目: 來源: 題型:
【題目】下列為四個常用的電化學裝置,關于它們的敘述正確的是
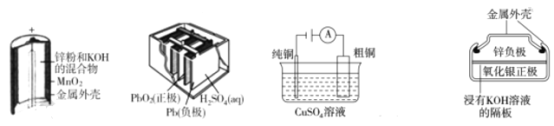
A.圖(a)中,MnO2的作用是催化劑
B.圖(b)所示電池放電過程中,兩極板的質量不斷增大
C.圖(c)所示裝置工作過程中,電解質溶液中Cu2+濃度始終不變
D.圖(d)所示電池充電過程中,Ag2O是氧化劑,電池工作過程中還原為Ag
查看答案和解析>>
科目: 來源: 題型:
【題目】氮化鋁(AlN)廣泛應用于電子、陶瓷等工業領域。在一定條件下,AlN可通過反應Al2O3+N2+3C![]() 2AlN+3CO合成。下列敘述正確的是( )
2AlN+3CO合成。下列敘述正確的是( )
A. 上述反應中,N2是還原劑,Al2O3是氧化劑
B. 上述反應中,每生成1molAlN需轉移3mol電子
C. AlN中氮元素的化合價為+3
D. CO是還原產物
查看答案和解析>>
科目: 來源: 題型:
【題目】pc類似pH,是指極稀溶液中溶質物質的量濃度的常用對數負值。如某溶液溶質的濃度為1×10-3mol/L,則該溶液溶質的pc=3。下列說法正確的是
A.25°C時,0.01mol/LNa2S水溶液中,pc(H+)+pc(OH-)=14
B.用0.01mol/L的NaOH溶液滴定某濃度的鹽酸,滴定過程中pc(OH-)逐漸增大
C.某溫度下,弱酸HB的Ka=1×10-5mol/L,則該溶液中pc(H+)+pc(B-)=l0
D.向0.0lmol/L的Ca(HCO3)2溶液中逐漸滴加燒堿溶液,滴加過程中pc(Ca2+)逐漸減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com