
科目: 來源: 題型:
【題目】現有短周期主族元素R、X、Y、Z。若它們的最外層電子數用n表示,則有:n(X)+n(Y)=n(Z),n(X)+n(Z)=n(R)。這四種元素組成一種化合物Q,Q具有下列性質:
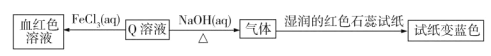
下列說法錯誤的是
A.原子半徑:Y>Z>XB.最高價氧化物對應水化物酸性:Y<Z
C.X和Y組成的化合物在常溫下都呈氣態D.Y3Z4是共價化合物
查看答案和解析>>
科目: 來源: 題型:
【題目】氮的氧化物是造成大氣污染的主要物質。研究氮氧化物的反應機理對于消除環境污染有重要意義。NO在空氣中存在如下反應:2NO(g)+ O2(g)![]() 2NO2(g) △H上述反應分兩步完成,如圖1所示。
2NO2(g) △H上述反應分兩步完成,如圖1所示。
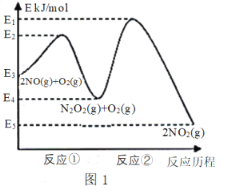
回答下列問題:
(1)寫出反應①的熱化學方程式(△H用含物理量E的等式表示):___________。
(2)反應①和反應②中,一個是快反應,會快速建立平衡狀態,而另一個是慢反應。決定2NO(g)+O2(g)![]() 2NO2(g)反應速率的是_______(填“反應①”或“反應②”);對該反應體系升高溫度,發現總反應速率變慢,其原因可能是_________(反應未使用催化劑)。
2NO2(g)反應速率的是_______(填“反應①”或“反應②”);對該反應體系升高溫度,發現總反應速率變慢,其原因可能是_________(反應未使用催化劑)。
(3)T1溫度時在容積為2L的恒容密閉容器中只充入1.00molNO2氣體發生反應:2NO(g)+O2(g)![]() 2NO2(g)。實驗測得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆為速率常數只受溫度影響。不同時刻測得容器中n(NO2)如表:
2NO2(g)。實驗測得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆為速率常數只受溫度影響。不同時刻測得容器中n(NO2)如表:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①從0~2s該反應的平均速率v(NO2)=___________mol/(L·s)。
②T1溫度時化學平衡常數K=___________mol-1·L。
③化學平衡常數K與速率常數k正、k逆的數學關系是K=___________。若將容器的溫度改變為T2時其k正=k逆,則T1__________T2 (填“>”、“<”或“=”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】尿素[CO(NH2)2]是首個由無機物人工合成的有機物。
(1)工業上尿素由CO2和NH3在一定條件下合成,其反應方程式為_________________________。
(2)人工腎臟可采用間接電化學方法除去代謝產物中的尿素,原理如圖:
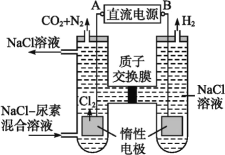
①電源的負極為________(填“A”或“B”)。
②陽極室中發生的反應依次為__________________________、____________________________。
③電解結束后,陰極室溶液的pH與電解前相比將________;若兩極共收集到氣體13.44 L(標準狀況),則除去的尿素為________g(忽略氣體的溶解)。
查看答案和解析>>
科目: 來源: 題型:
【題目】氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等化工產品。如圖是離子交換膜法電解食鹽水的示意圖,圖中的離子交換膜只允許陽離子通過。
回答下列問題:
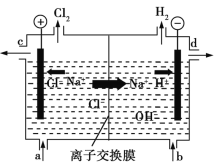
(1)寫出電解飽和食鹽水的離子方程式:_______________________________。
(2)離子交換膜的作用為_________________。
(3)精制飽和食鹽水從圖中____(填“a”、“b”、“c”或“d”,下同)位置補充,氫氧化鈉溶液從圖中____位置流出。
(4)KClO3可以和草酸(H2C2O4)、硫酸反應生成高效的消毒殺菌劑ClO2,還生成CO2和KHSO4等物質。寫出該反應的化學方程式:____________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】通常監測SO2含量是否達到排放標準的反應原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.0.1 molBaCl2晶體中所含離子總數為0.1NA
B.25℃時,pH=1的HCl溶液中含有H+ 的數目為0.1NA
C.l7g H2O2中含有非極性鍵數目為0.5NA
D.生成2.33gBaSO4沉淀時,轉移電子數目為0.01NA
查看答案和解析>>
科目: 來源: 題型:
【題目】鉻鐵礦的成分主要為 FeCr2O4 ,另含有少量 Al2O3 和 SiO2 。從鉻鐵礦中提取鐵、鉻的化合物,并獲得副產物的工藝流程如下:
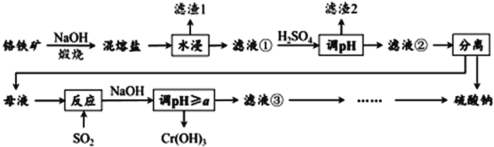
已知:鉻鐵礦FeCr2O4 中Cr元素在化合價為+3,“ 混熔鹽 ” 中含有 Na2CrO4 和 NaFeO2 等成分,其中 NaFeO2 極易水解。試回答下列問題:
(1) “濾渣 1 ”為紅褐色沉淀,其化學式為 _________________ ;
(2) 向濾液①中加 H2SO4 “調“ pH ”的目的:一是使 CrO![]() 轉化為 Cr2O
轉化為 Cr2O![]() ,離子方程式為 __________________ ;二是______________ 。
,離子方程式為 __________________ ;二是______________ 。
(3) “煅燒”鉻鐵礦時,主要成分反應的化學方程式為 _____________________ 。
(4) 根據下圖溶解度(S)~溫度(T) 曲線判斷,

對濾液②進行的最佳“分離”方法為 ________( 填序號 ) 。
A. 蒸發結晶 B. 蒸發濃縮,趁熱過濾 C. 蒸發濃縮,冷卻結晶,過濾
(5) “反應”的離子方程式為 ____________________________ 。
(6) 已知 25 ℃時,Cr(OH) 3 的溶度積常數 Ksp [Cr(OH) 3 ]= 1.0 × 10 -32 。則使 Cr 3+恰好完全沉淀,即溶液中c(Cr 3+ )=1.0 × 10 -5 mol/L 時,應調節pH 的最小值a為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】在T℃時,向1 L固定體積的密閉容器M中加入2 mol X和1 mol Y,發生如下反應:2X(g)+Y(g) ![]() aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);該反應達到平衡后,放出的熱量為Q1 kJ,物質X的轉化率為α;若平衡后再升高溫度,混合氣體的平均相對分子質量減小。請回答下列問題:
aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);該反應達到平衡后,放出的熱量為Q1 kJ,物質X的轉化率為α;若平衡后再升高溫度,混合氣體的平均相對分子質量減小。請回答下列問題:
(1)化學計量數a的值為________。
(2)下列能說明該反應達到了化學平衡狀態的是________(填序號)。
a.容器內壓強一定 b.容器內氣體的密度一定
c.容器內Z的分子數一定 d.容器內氣體的質量一定
(3)維持T℃溫度不變,若起始時向容器M中加入2 mol X、1 mol Y和1 mol Ar(稀有氣體不參與反應),則反應達到平衡后放出的熱量是________kJ。
(4)維持T℃溫度不變,若在一個和原容器體積相等的恒壓容器N中加入2 mol X和1 mol Y,發生題給反應并達到平衡,則________(填“M”或“N”)容器中的反應先達到平衡狀態,容器中X的質量分數M________N(填“>”、“<”或“=”)。
(5)已知:該反應的平衡常數隨溫度的變化情況如表所示:
溫度/℃ | 200 | 250 | 300 | 350 |
平衡常數K | 9.94 | 5.2 | 1 | 0.5 |
若在某溫度下,2 mol X和1 mol Y在容器M中反應并達到平衡,X的平衡轉化率為50%,則該溫度為________℃。
查看答案和解析>>
科目: 來源: 題型:
【題目】一定溫度下,在三個體積均為2.0 L的恒容密閉容器中發生反應:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
編號 | 溫度 /℃ | 起始物質 的量/mol | 平衡物質 的量/mol | 達到平衡 所需時間/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列說法正確的是
A.平衡常數K:容器Ⅱ>容器Ⅲ
B.反應到達平衡時,PCl5的轉化率:容器Ⅱ>容器Ⅰ
C.反應到達平衡時,容器Ⅰ中的平均速率為v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始時向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,則反應將向逆反應方向進行
查看答案和解析>>
科目: 來源: 題型:
【題目】藥物Targretin(F)能治療頑固性皮膚T—細胞淋巴瘤,其合成路線如圖所示:

已知:
i. 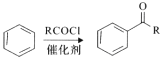
ii. ![]()
![]()
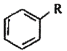
iii.RCOOH![]() RCOCl(R表示烴基或芳基)
RCOCl(R表示烴基或芳基)
(1)反應①的反應類型是_______________。
(2)B的結構簡式___________。
(3) ![]() 的名稱_____________。
的名稱_____________。
(4)C的核磁共振氫譜中顯示峰的面積之比為_________________。
(5)反應③的化學方程式__________。
(6)F的分子式是C24H28O2,F中含有的官能團名稱____________。
(7)寫出滿足下列條件A的兩種同分異構體的結構簡式(不考慮—O—O—或![]() 結構)__________、____________。
結構)__________、____________。
a.苯環上的一氯代物有兩種
b.既能發生銀鏡反應又能發生水解反應
(8)已知: ![]() (R、R′表示烴基或芳基)。以2-溴丙烷和乙二醇為原料,選用必要的無機試劑合成
(R、R′表示烴基或芳基)。以2-溴丙烷和乙二醇為原料,選用必要的無機試劑合成![]() ,寫出合成路線________。
,寫出合成路線________。
查看答案和解析>>
科目: 來源: 題型:
【題目】三氯氧磷(POCl3)是一種重要的化工原料,常用作半導體摻雜劑。實驗室制取POCl3并測定產品含量的實驗過程如下:
Ⅰ.制備POCl3。采用氧氣氧化液態PCl3法,實驗裝置(加熱及夾持裝置省略)及相關信息如下:
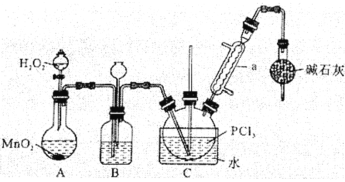
物質 | 熔點/℃ | 沸點/℃ | 相對分子質量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 均為無色液體;遇水均劇烈水解為含氧酸和氯化氫;兩者互溶。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)儀器a的名稱為______。
(2)裝置C中生成POCl3的化學方程式為__________。
(3)裝置B的作用除觀察O2的流速之外,還有_________、________。
(4)反應溫度應控制在60-65℃之間,原因是__________。
Ⅱ.測定POCl3產品的含量。
實驗步驟:
①實驗Ⅰ結束后,待三頸燒瓶中液體冷卻到室溫,準確稱取16.725gPOCl3,產品,置于盛60.00mL蒸餾水的水解瓶中搖動至完全水解,將水解液配成100.00mL溶液。
②取10.00mL溶液于錐形瓶中,加入10.00mL3.2mol·L-1AgNO3溶液,使氯離子完全沉淀;向其中加入少量硝基苯并用力搖動。
③以硫酸鐵溶液為指示劑,用0.2 mol·L-1KSCN溶液滴定過量的AgNO3溶液,達滴定終點時共用去10.00mLKSCN溶液。
己知:Ag++SCN-=AgSCN↓;Ksp(AgCl)>Ksp(AgSCN)。
(5)達滴定終點時的現象為____________。
(6)實驗過程中加入硝基苯的目的是__________;若無此操作,則所測POCl3的含量將____________(填“偏高”、“偏低”或“不變”)。
(7)測得產品POCl3的百分含量為________(保留三位有效數字)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com