
科目: 來源: 題型:
【題目】A~F是幾種烴分子的球棍模型(如下圖),據此回答下列問題:
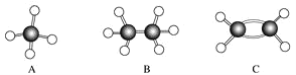
(1)屬于同系物的是________;
(2)常溫下含碳量最高的氣態烴的分子式是____________________________________;
(3)能夠發生加成反應的烴有(填數字)________種;
(4)寫出C與溴的四氯化碳溶液反應的化學方程式________________;
(5)寫出F與溴發生取代反應的化學方程式___________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某學生為比較鎂、鋁的金屬性強弱,設計了如下實驗:
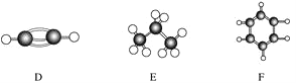
(1)向兩支試管中分別加入3mL同濃度的稀鹽酸,再將兩塊大小相同且純凈的鎂片和鋁片分別加入試管中,反應完全后觀察到如圖所示的現象,則試管b內加入的金屬為____________(寫化學式)。
(2)若加入的兩塊金屬的物質的量相等,且試管中稀鹽酸足量,充分反應后,氣球狀態也如圖所示,則試管b中反應的離子方程式為____________。
(3)分析判斷,實驗________[填“(1)”或“(2)”]能證明鎂的金屬性強于鋁。
查看答案和解析>>
科目: 來源: 題型:
【題目】下表是元素周期表中的一部分,回答下列問題:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ | ⑾ | ⑿ |
(1)寫出下列元素名稱①_______,⑤_______,⑨_______,⑾________。
(2)在這些元素中,金屬性最強的元素是_______;除稀有氣體元素以外的元素中原子半徑最大的是_______,原子半徑最小的是______。其氫化物最穩定的是____。(填寫元素符號)
(3)元素②和③形成的離子的電子層結構_________(填“相同”或“不相同”),兩者形成的化合物是否是離子化合物________(填“是”或否”),該化合物的電子式為______________。
(4)元素⑧的最高價氧化物對應的水化物化學式為:______名稱為______:。
(5)在這些元素的最高價氧化物對應的水化物中,屬于兩性氫氧化物的是_________(填寫化學式),寫出其和鹽酸反應的化學方程式__________________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】為了驗證木炭可被濃H2SO4氧化成CO2,選用下圖所示儀器(內含物質)組裝成實驗裝置:

(1)如按氣流由左向右流向,連接上述裝置的正確順序是(填各接口字母):
接 , 接 , 接 ;
(2)儀器乙、丙應有怎樣的實驗現象才表明已檢驗出CO2?
乙中 ____ ,丙中 ______ ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)寫出甲中反應的化學方程式 。
查看答案和解析>>
科目: 來源: 題型:
【題目】用如圖所示裝置進行實驗(a、b電極均為Ag單質),觀察到了靈敏電流計指針發生偏轉。下列說法正確的是
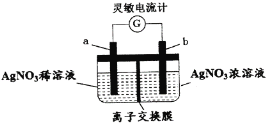
A.b極發生氧化反應
B.離子交換膜為陰離子交換膜
C.去掉離子交換膜,電流表仍然有電流通過
D.電流計指針不再偏轉時,右邊硝酸銀溶液的物質的量濃度依然大于左邊
查看答案和解析>>
科目: 來源: 題型:
【題目】下列關于有機物的說法正確的是
A.分子式符合C8H8的有機物都能使酸性高錳酸鉀溶液褪色
B.存在立體異構的鏈烴中,碳原子數最少的一定是2-丁烯
C.葡萄糖與核糖互為同系物
D.C8H8O2芳香族化合物分子中可能含有兩個醛基
查看答案和解析>>
科目: 來源: 題型:
【題目】鹵族元素包括氟、氯、溴、碘、砹等元素,位于元素周期表中第ⅦA族。
(1)畫出下列鹵族元素的原子結構示意圖:①氟________;②氯________③溴________;④碘_________。
(2)比較鹵族元素的原子結構:
①它們在結構上的相同點是____________;
②它們在結構上的不同點是_____________。
(3)鹵族元素原子結構的變化規律是_______________。
查看答案和解析>>
科目: 來源: 題型:
【題目】短周期元素A、B、C、D的位置如右圖所示, B、C兩元素的原子序數之和是A元素原子序數的4倍,各元素對應的物質相互比較,其中關系正確的是

A.原子半徑:C>D>AB.單質的熔點:B>C,D>A
C.最高正價:B>D=A>CD.氣態氫化物的穩定性:B>C,D>A
查看答案和解析>>
科目: 來源: 題型:
【題目】I、如圖所示,X是一種生活中常見的金屬元素,A、B、C、D為石墨電極,E、F分別為短周期相鄰兩種活潑金屬中的一種,且E能與NaOH溶液反應。按圖示接通線路,反應一段時間(實驗中所有溶液均足量)。

(1)甲池是___(填“原電池”或“電解池”,下同]裝置;乙池是___裝置。
(2)D極為___(填“陰極”或“陽極”)。
(3)燒杯中溶液會變藍的是_______(填“a”或“b”);C極上的電極反應式為____。
(4)F極上的電極反應式為:____。
(5)當電路中通過0.02mol電子時,B電極上沉積0.64g金屬X,則X為___(填元素符號),甲池中反應的化學方程式為___。
II、(1)從輝銅礦中浸取銅元素,可用FeCl3作浸取劑。
①反應Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反應中轉移電子的數目為____;浸取時,在有氧環境下可維持Fe3+較高濃度。有關反應的離子方程式是___。
②浸取過程中加入洗滌劑溶解硫時,銅元素的浸取率的變化見如圖1。其原因是___。

③353K時,向FeCl3浸取液中加入CuCl2,能加快銅元素的浸取速率,其反應原理可用化學方程式表示為:___,CuCl+FeCl3=CuCl2+FeCl2。
(2)輝銅礦可由黃銅礦(主要成分為CuFeS2)通過電化學反應轉變而成,有關轉化見如圖2。轉化時正極的電極反應式為___。

查看答案和解析>>
科目: 來源: 題型:
【題目】甲醇是一種很好的燃料,工業上在一定條件下可利用反應I和II來制備:
(1)已知在25°C、101kPa下,1g甲醇燃燒生成CO2和液態水時放熱22.68kJ,則表示燃燒熱的熱化學方程式為___
(2)將1.0molCH4和2.0molH2O(g)通入容積為10L密閉容器中,CH4(g)+H2O(g)CO(g)+3H2(g)(I)CH4的轉化率與溫度、壓強的關系如圖所示:

①該反應的△H__0,△S__0(填“<”、“>”或“=”);
②已知100℃時達到平衡所需的時間為5min,則用H2表示的平均反應速率為___,該反應的平衡常數為___(mol·L-1)2。
(3)在壓強為0.1MPa條件下,amolCO與3amolH2的混合氣體在催化劑作用下能自發反應生成甲醇:CO(g)+2H2(g)CH3OH(g)△H<0(Ⅱ)若容器的容積不變,下列措施可增大甲醇產率的是___(填序號)。
A.升高溫度 B.將CH3OH(g)從體系中分離出來
C.恒容下充入He,使體系的總壓強增大 D.再充入amolCO和3amolH2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com