
科目: 來源: 題型:
【題目】25℃時,三種酸的電離平衡常數如下:
化學式 | CH3COOH | H2CO3 | HClO |
電離平衡常數 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列問題:
(1)一般情況下,當溫度升高時,Ka________(填“增大”、“減小”或“不變”)。
(2)下列四種離子結合H+能力由大到小的順序是______________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反應不能發生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸餾水稀釋醋酸,下列各式表示的數值隨水量的增加而增大的是______(填字母)。
a.c(CH3COOH)/c(H+) b. c(CH3COO-)/c(CH3COOH) c. c(H+)/Ka d.c(H+)/c(OH-)
(5)體積均為10 mL、pH均為2的醋酸溶液與HX溶液分別加水稀釋至1000 mL,稀釋過程中pH變化如下圖所示。
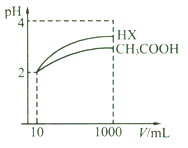
則HX的電離平衡常數________(填“>”、“=”或“<”,下同)醋酸的電離平衡常數;稀釋后,HX溶液中水電離出來的c(H+)_____醋酸溶液中水電離出來的c(H+);用同濃度的NaOH溶液分別中和上述兩種酸溶液,恰好中和時消耗NaOH溶液的體積:醋酸____HX。
(6)25℃時,測得CH3COOH與CH3COONa的混合溶液pH=6,則溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精確數值)。
查看答案和解析>>
科目: 來源: 題型:
【題目】向2 L密閉容器中通入a mol氣體A和b mol氣體B,在一定條件下發生反應:xA(g)+yB(g)pC(g)+qD(g)已知:平均反應速率v(C)=![]() v(A);反應2 min時,A的濃度減少了
v(A);反應2 min時,A的濃度減少了![]() a mol,B的物質的量減少了
a mol,B的物質的量減少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列問題:
(1)反應2 min內,v(A)=________,v(B)=________。
(2)化學方程式中,x=________,y=________,p=________,q=________。
(3)反應平衡時,D為2a mol,則B的轉化率為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某溫度下,等體積、PH相同的鹽酸和醋酸溶液分別加水稀釋,溶液中的隨溶液體積變化的曲線如圖所示。據圖判斷下列說法正確的是

A.b點酸的總濃度大于a點酸的總濃度
B.b點溶液的導電性比c點溶液的導電性弱
C.取等體積的a點、b點對應的溶液,消耗的NaOH的量相同
D.曲線Ⅰ表示的是鹽酸的變化曲線
查看答案和解析>>
科目: 來源: 題型:
【題目】某小組同學探究物質的溶解度大小與沉淀轉化方向之間的關系。已知:
物質 | BaSO4 | BaCO3 | AgI | AgCl | |
溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(1)探究BaCO3和BaSO4之間的轉化
實驗操作:
試劑A | 試劑B | 試劑C | 加入鹽酸后的現象 | |
實驗Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
實驗Ⅱ | Na2SO4 | Na2CO3 | 有少量氣泡產生,沉淀部分溶解 |
① 實驗Ⅰ說明BaCO3全部轉化為BaSO4,依據的現象是加入鹽酸后,______。
② 實驗Ⅱ中加入稀鹽酸后發生反應的離子方程式是______。
③ 實驗Ⅱ說明沉淀發生了部分轉化,結合BaSO4的沉淀溶解平衡解釋原因:______。
(2)探究AgCl和AgI之間的轉化
實驗Ⅲ:
實驗Ⅳ:在試管中進行溶液間反應時,同學們無法觀察到AgI轉化為AgCl,于是又設計了如下實驗(電壓表讀數:a>c>b>0)。
裝置 | 步驟 | 電壓表讀數 | |
| ⅰ.如圖連接裝置并加入試劑,閉合K | a | |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | ||
ⅲ.再向B中投入一定量NaCl (s) | c | ||
ⅳ.重復ⅰ,再向B中加入與ⅲ等量NaCl(s) | a |
注:其他條件不變時,參與原電池反應的氧化劑(或還原劑)的氧化性(或還原性)越強,原電池的電壓越大;離子的氧化性(或還原性)強弱與其濃度有關。
① 實驗Ⅲ證明了AgCl轉化為AgI,甲溶液可以是______(填序號)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 實驗Ⅳ的步驟ⅰ中,B中石墨上的電極反應式是______。
③ 結合信息,解釋實驗Ⅳ中b<a的原因:______。
④ 實驗Ⅳ的現象能說明AgI轉化為AgCl,理由是______。
(3)綜合實驗Ⅰ~Ⅳ,可得出結論: ______。
查看答案和解析>>
科目: 來源: 題型:
【題目】某天然氨基酸M是人體必需的氨基酸之一,其合成路線如下:

已知:

回答下列問題:
(1)A→B的反應條件和試劑是___________,反應類型是_______________。
(2)化合物M的名稱為_________________,其含有_______________個手性碳原子。
(3)寫出D→E反應的化學方程式:___________________。
(4)I與乙二醇反應可生成能降解的高分子化合物N,寫出該反應的化學方程式:___________________。
(5)符合下列條件的化合物M的同分異構體共有____________種(不考慮立體異構),其中核磁共振氫譜峰面積比為1∶1∶2∶2∶2∶3的分子的結構簡式:______________(任寫一種)。
①含有苯甲酸結構 ②含有一個甲基 ③苯環上只有兩個取代基
(6)L與NaOH反應的化學方程式為______________________。
(7)請結合以上合成路線,寫出以丙酸和上述流程中出現的物質為原料經三步合成丙氨酸(![]() )的路線_______。
)的路線_______。
查看答案和解析>>
科目: 來源: 題型:
【題目】CO2的資源化利用能有效減少CO2排放,充分利用碳資源。
(1)CaO可在較高溫度下捕集CO2,在更高溫度下將捕集的CO2釋放利用。CaC2O4·H2O熱分解可制備CaO,CaC2O4·H2O加熱升溫過程中固體的質量變化見下圖。

①寫出400~600 ℃范圍內分解反應的化學方程式:________。
②與CaCO3熱分解制備的CaO相比,CaC2O4·H2O熱分解制備的CaO具有更好的CO2捕集性能,其原因是________。
(2)電解法轉化CO2可實現CO2資源化利用。電解CO2制HCOOH的原理示意圖如下。

①寫出陰極CO2還原為HCOO的電極反應式:________。
②電解一段時間后,陽極區的KHCO3溶液濃度降低,其原因是________。
(3)CO2催化加氫合成二甲醚是一種CO2轉化方法,其過程中主要發生下列反應:
反應Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反應Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒壓、CO2和H2的起始量一定的條件下,CO2平衡轉化率和平衡時CH3OCH3的選擇性隨溫度的變化如圖。其中:

CH3OCH3的選擇性=![]() ×100%
×100%
①溫度高于300 ℃,CO2平衡轉化率隨溫度升高而上升的原因是________。
②220 ℃時,在催化劑作用下CO2與H2反應一段時間后,測得CH3OCH3的選擇性為48%(圖中A點)。不改變反應時間和溫度,一定能提高CH3OCH3選擇性的措施有________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某小組同學通過實驗研究FeCl3溶液與Cu發生的氧化還原反應,實驗記錄如下表所示,下列說法錯誤的是( )
序號 | Ⅰ | Ⅱ | Ⅲ |
實驗步驟 |
充分振蕩,加入2mL蒸餾水 |
充分振蕩,加入2mL蒸餾水 |
充分振蕩,加入2mL蒸餾水 |
實驗現象 | 銅粉消失,溶液黃色變淺,加入蒸餾水后無明顯現象 | 銅有剩余,溶液黃色褪去,加入蒸餾水后生成白色沉淀 | 銅有剩余,溶液黃色褪去,變成藍色加入蒸餾水后無白色沉淀 |
A.實驗Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被還原
B.對比實驗Ⅰ、Ⅱ、Ⅲ說明白色沉淀的產生可能與銅粉的量及溶液中陰離子種類有關
C.實驗Ⅱ、Ⅲ中加水后c(Cu2+)相同
D.向實驗Ⅲ反應后的溶液中加入飽和NaCl溶液可能出現白色沉淀
查看答案和解析>>
科目: 來源: 題型:
【題目】鉛的冶煉有很多種方法。
(1)瓦紐科夫法熔煉鉛,其相關反應的熱化學方程式如下:
① 2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
② PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2=b kJ·mol-1
③ PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1
反應PbS(s)+2O2(g)=PbSO4(s) ΔH=______________ kJ·mol-1(用含a、b、c的代數式表示)。
(2)還原法煉鉛,包含反應PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,該反應的平衡常數的對數值與溫度的關系如下表:
Pb(s)+CO2(g) ΔH,該反應的平衡常數的對數值與溫度的關系如下表:
溫度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①該反應的ΔH_______0(選填“>”、“<”或“=”)。
②當lgK=1,在恒容密閉容器中放入PbO并通入CO,達平衡時,混合氣體中CO的體積分數為______________ (保留兩位有效數字);若向容器中充入一定量的CO氣體后,平衡向_________ (填“正向”、“逆向”或“不”)移動,再次達到平衡時,CO的轉化率_________(填“增大”、“減小”或“不變”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】利用反應6NO2+8NH3=7N2+12H2O構成電池的方法,既能實現有效消除氮氧化物的排放,減輕環境污染,又能充分利用化學能,裝置如圖所示。

下列說法不正確的是
A. 電流從右側電極經過負載后流向左側電極
B. 為使電池持續放電,離子交換膜需選用陰離子交換膜
C. 電極A極反應式為:2NH3-6e-=N2+6H+
D. 當有4.48LNO2(標準狀況) 被處理時,轉移電子為0.8mol
查看答案和解析>>
科目: 來源: 題型:
【題目】氫氧燃料電池常用于航天飛船,由電極反應產生的水經冷凝后可作為航天員的飲用水,其電極反應如下:
負極:2H2+4OH--4e-=4H2O
正極:O2+2H2O+4e-=4OH-
當得到1.8 kg飲用水時,電池內轉移電子的物質的量為
A.1.8 mol
B.3.6 mol
C.100 mol
D.200 mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com