
科目: 來源: 題型:
【題目】一定質量的鎂和鋁分別與等濃度、等體積的過量稀硫酸反應,產生氣體的體積(V)與時間(t)關系如右圖。下列關于反應的說法錯誤的是
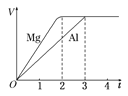
A.鎂和鋁的物質的量之比為3∶2
B.鎂和鋁轉移電子數之比為1∶1
C.鎂和鋁的摩爾質量之比為8∶9
D.鎂和鋁反應所用時間之比為3∶2
查看答案和解析>>
科目: 來源: 題型:
【題目】正丁醚常用作有機反應的溶劑。實驗室制備正丁醚的反應和主要實驗裝置如下:
2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
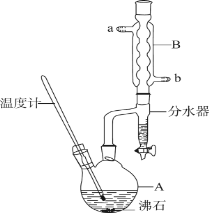
反應物和產物的相關數據如下:
相對分子質量 | 沸點/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 幾乎不溶 |
合成反應:
①將一定量的濃硫酸和正丁醇,按一定順序添加到A中,并加幾粒沸石。
②加熱A中反應液,迅速升溫至135℃,維持反應一段時間。
分離提純:
③待A中液體冷卻后將其緩慢倒入盛有一定量水的分液漏斗中,振搖后靜置,分液得粗產物。
④粗產物依次用蒸餾水、NaOH溶液和蒸餾水洗滌,分液后再加入一定質量的無水氯化鈣顆粒,靜置一段時間后棄去氯化鈣。
⑤將上述處理過的粗產物進行蒸餾,收集餾分,得正丁醚。
請回答:
(1)步驟①中濃硫酸和正丁醇的添加順序為________。
(2)加熱A前,需先從________(填“a”或“b”)口向B中通入水。
(3)步驟②中,若溫度控制不當,最容易產生副產物的結構簡式為________。
(4)分液漏斗在使用前須清洗干凈并________,步驟③中粗產物應從分液漏斗的________(填“上”或“下”)口分離出。
(5)步驟④中加入NaOH溶液洗滌的目的為________。
(6)步驟⑤中,加熱蒸餾時應收集________(填選項字母)左右的餾分。
a.100℃ b.117℃ C.135℃ d.142℃
(7)反應過程中會觀察到分水器中收集到液體物質,且分為上下兩層,隨著反應的進行,分水器中液體逐漸增多至充滿時,上層液體會從左側支管自動流回A。分水器中上層液體的主要成分為________,下層液體的主要成分為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列物質的轉化在給定條件下能實現的是( )
① C![]() CO2
CO2![]() CO
CO![]() CO2
CO2
② Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
③SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO4
(NH4)2SO4
④AlCl3![]() Al
Al![]() NaAlO2
NaAlO2
⑤CuSO4(aq)![]() Cu(OH)2
Cu(OH)2![]() Cu2O
Cu2O
A.①②③B.①③⑤C.②③⑤D.③④⑤
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖是中學化學中常見物質之間的一些反應關系,其中部分產物未寫出。常溫下X是固體,B和G是液體,其余均為氣體。根據下圖關系推斷:

(1)寫出化學式:X_______,A________,B_______。
(2)實驗室收集氣體D和F的方法依次是_______法、________法。
(3)寫出C→E的化學方程式:____________。
(4)請寫出A與E反應生成D的化學方程式:_______________
(5)檢驗物質A的方法和現象是________________
查看答案和解析>>
科目: 來源: 題型:
【題目】下列反應與對應的圖像相符合的是

A.I :N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.II : 2SO3(g) ![]() 2SO2(g)+O2(g)ΔH>0
2SO2(g)+O2(g)ΔH>0
C.III : 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
D.IV: H2(g)+CO(g) ![]() C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
查看答案和解析>>
科目: 來源: 題型:
【題目】有一處于平衡狀態的可逆反應:X(s)+3Y(g)![]() 2Z(g) ΔH<0。為了使平衡向生成Z的方向移動,應選擇的條件是
2Z(g) ΔH<0。為了使平衡向生成Z的方向移動,應選擇的條件是
①高溫 ②低溫 ③高壓 ④低壓 ⑤加催化劑 ⑥分離出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
查看答案和解析>>
科目: 來源: 題型:
【題目】鋰二次電池新正極材料的探索和研究對鋰電池的發展非常關鍵。
(1) 鋰硒電池具有優異的循環穩定性。
①正極材料Se可由SO2通入亞硒酸(H2SeO3)溶液反應制得,則該反應的化學方程式為__。
②一種鋰硒電池放電時的工作原理如圖1所示,寫出正極的電極反應式:________________。充電時Li+向________(填“Se”或“Li”)極遷移。
③ Li2Sex與正極碳基體結合時的能量變化如圖2所示,圖中3種Li2Sex與碳基體的結合能力由大到小的順序是________。
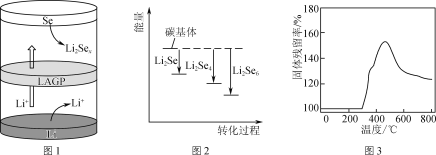
(2) Li2S電池的理論能量密度高,其正極材料為碳包裹的硫化鋰(Li2S)。
① Li2S可由硫酸鋰與殼聚糖高溫下制得,其中殼聚糖的作用是________。
②取一定量Li2S樣品在空氣中加熱,測得樣品固體殘留率隨溫度的變化如圖3所示。(固體殘留率=![]() ×100%)分析300 ℃后,固體殘留率變化的原因是________。
×100%)分析300 ℃后,固體殘留率變化的原因是________。
查看答案和解析>>
科目: 來源: 題型:
【題目】對于可逆反應:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反應物中活化分子百分數、化學反應速率和化學平衡常數都變化的是( )
2SO3(g),下列措施能使反應物中活化分子百分數、化學反應速率和化學平衡常數都變化的是( )
A. 增大壓強 B. 升高溫度 C. 使用催化劑 D. 多充O2
查看答案和解析>>
科目: 來源: 題型:
【題目】在紫外線的作用下,氧氣可生成臭氧:3O2![]() 2O3,一定條件下該反應達到平衡狀態的標志是( )
2O3,一定條件下該反應達到平衡狀態的標志是( )
A. 單位時間內生成2 mol O3,同時消耗3 mol O2
B. O2的消耗速率0.3 mol·L-1·s-1,O3的消耗速率0.2 mol·L-1·s-1
C. 容器內,2種氣體O3、O2濃度相等
D. 氣體密度不再改變
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com