
科目: 來源: 題型:
【題目】氮的化合物在生產生活中廣泛存在。
(1)氯胺(NH2Cl)的電子式為___。可通過反應NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制備氯胺,已知部分化學鍵的鍵能如表所示(假定不同物質中同種化學鍵的鍵能一樣),則上述反應的ΔH=___。
化學鍵 | N-H | Cl-Cl | N-Cl | H-Cl |
鍵能/(kJ·mol-1) | 391 | 243 | 191 | 431 |
(2)液氨中存在電離平衡2NH3(l)![]() NH
NH![]() +NH
+NH![]() ,用Pt電極對液氨進行電解也可產生H2和N2。陰極的電極反應式是___。
,用Pt電極對液氨進行電解也可產生H2和N2。陰極的電極反應式是___。
(3)用焦炭還原NO的反應為:2NO(g)+C(s)![]() N2(g)+CO2(g),向容積均為1L的甲、乙、丙三個恒容恒溫(反應溫度分別為400℃、400℃、T℃)容器中分別加入足量的焦炭和一定量的NO,測得各容器中n(NO)隨反應時間t的變化情況如表所示:
N2(g)+CO2(g),向容積均為1L的甲、乙、丙三個恒容恒溫(反應溫度分別為400℃、400℃、T℃)容器中分別加入足量的焦炭和一定量的NO,測得各容器中n(NO)隨反應時間t的變化情況如表所示:
t/min | 0 | 20 | 40 | 60 | 80 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①該反應為___(填“放熱”或“吸熱”)反應,理由是___;
②下列選項中可以說明容器乙已經達到平衡狀態的是___(填序號)
A.容器內壓強不變
B.容器內氣體的密度不變
C.2υ正(NO)=υ逆(N2)
D.混合氣體的平均摩爾質量不變
③乙容器在100min達到平衡狀態,則0~100min內用NO的濃度變化表示的平均反應速率υ(NO)=___,平衡常數K(400℃)=___。
查看答案和解析>>
科目: 來源: 題型:
【題目】銦產業被稱為“信息時代的朝陽產業”。元素周期表中銦的數據見下圖,下列說法正確的是( )
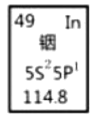
A.銦元素的質量數是114.8
B.銦元素的相對原子質量是115,中子數為66
C.銦元素是一種主族元素,位于第五周期第ⅢA族
D.銦原子最外層有5個電子
查看答案和解析>>
科目: 來源: 題型:
【題目】現在含有生命元素硒(![]() )的保健品已經進入市場,已知硒與氧同族,與鉀同周期,則下列關于硒的敘述中正確的是( )
)的保健品已經進入市場,已知硒與氧同族,與鉀同周期,則下列關于硒的敘述中正確的是( )
A.硒單質在常溫下是固體
B.硒的氣態氫化物穩定性比![]() 強
強
C.硒是金屬元素
D.硒酸(![]() )的酸性比硫酸強
)的酸性比硫酸強
查看答案和解析>>
科目: 來源: 題型:
【題目】某溫度下,向一定體積0.1mol/L氨水中逐滴加入相同濃度的鹽酸,溶液中pH與pOH的變化關系如圖所示。下列說法錯誤的是( )

A.此溫度下,水的離子積常數為1.0×10-2a
B.N點溶液加水稀釋,![]() 增大
增大
C.M、Q、N三點所示的溶液中均存在:c(NH![]() )+c(H+)=c(OH-)+c(Cl-)
)+c(H+)=c(OH-)+c(Cl-)
D.Q點消耗的鹽酸的體積等于氨水的體積
查看答案和解析>>
科目: 來源: 題型:
【題目】W、X、Y和Z為原子序數依次增大的四種短周期元素。X是短周期原子半徑最大的元素,Y的最高化合價與最低價相加為0,Z是同周期非金屬性最強的元素,W、X、Y三種元素形成的一種化合物結構如圖所示。下列敘述正確的是
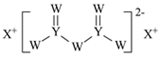
A.X單質的熔點高于Y單質
B.氣態氫化物穩定性:Y<Z
C.Z的氧化物對應的水化物為強酸
D.X分別與W、Z形成的二元化合物溶于水顯堿性
查看答案和解析>>
科目: 來源: 題型:
【題目】具有相同電子層數的![]() 、
、![]() 、
、![]() 三種元素,已知它們最高價氧化物的水化物的酸性強弱順序是
三種元素,已知它們最高價氧化物的水化物的酸性強弱順序是![]() ,則下列判斷正確的是( )
,則下列判斷正確的是( )
A.原子半徑:![]()
B.元素的非金屬性:![]()
C.氣體氫化物的穩定性:![]()
D.陰離子的還原性:![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】用除去表面氧化膜的細鋁條緊緊纏繞在溫度計上(如圖),將少許硝酸汞溶液滴到鋁條表面,置于空氣中,很快鋁條表面產生“白毛”,且溫度明顯上升。下列分析錯誤的是

A.Al和O2化合放出熱量B.硝酸汞是催化劑
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化鋁
查看答案和解析>>
科目: 來源: 題型:
【題目】鈉是一種非常活潑、具有廣泛應用的金屬。
(1)鈉的原子結構示意圖為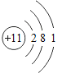 ,鈉在反應中容易___電子(填“得到”或“失去”)。
,鈉在反應中容易___電子(填“得到”或“失去”)。
(2)金屬鈉非常活潑,通常保存在________里,以隔絕空氣。
(3)汽車安全氣囊的氣體發生劑NaN3可由金屬鈉生產。某汽車安全氣囊內含NaN3、Fe2O3和NaHCO3等物質。
ⅰ.當汽車發生較嚴重的碰撞時,引發NaN3分解2NaN3 = 2Na + 3N2,從而為氣囊充氣。N2的電子式為_________。
ⅱ.產生的Na立即與Fe2O3發生置換反應生成Na2O,化學方程式是________。
ⅲ.NaHCO3是冷卻劑,吸收產氣過程釋放的熱量。NaHCO3起冷卻作用時發生反應的化學方程式為________。
ⅳ.一個安全氣囊通常裝有50 g NaN3,其完全分解所釋放的N2為_______mol。
(4)工業通過電解NaCl生產金屬鈉:2NaCl(熔融)![]() 2Na+Cl2,過程如下:
2Na+Cl2,過程如下:
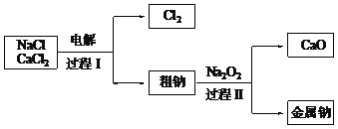
已知:電解時需要將NaCl加熱至熔融狀態。NaCl的熔點為801℃,為降低能耗,通常加入CaCl2從而把熔點降至約580℃。
①把NaCl固體加熱至熔融狀態,目的是________。
②電解時,要避免產生的Na與Cl2接觸而重新生成NaCl。用電子式表示NaCl的形成過程________。
③粗鈉中含有少量雜質Ca,過程Ⅱ除去Ca的化學方程式是________。
④過程Ⅰ中,CaCl2能發生像NaCl那樣的電解反應而被消耗。但在過程Ⅰ中CaCl2卻不斷地被重新生成,原因是________。
查看答案和解析>>
科目: 來源: 題型:
【題目】白屈菜有止痛、止咳等功效,從其中提取的白屈菜酸的結構簡式如圖所示。下列有關白屈菜酸的說法中不正確的是( )

A.白屈菜酸的同分異構體中可能含有芳香族化合物
B.所有碳原子可以共面
C.1mol白屈菜酸完全燃燒需要O2的物質的量為4mol
D.能通過加聚反應形成高分子物質
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室中有一未知濃度的稀鹽酸,某學生為測定鹽酸的濃度在實驗室中進行如下實驗:請完成下列填空:
(1)配制100mL 0.1000mol/L NaOH標準溶液。
(2)取20.00mL待測稀鹽酸溶液放入錐形瓶中,并滴加2~3滴酚酞作指示劑,用自己配制的標準NaOH溶液進行滴定。重復上述滴定操作2~3次,記錄數據如下。
實驗編號 | NaOH溶液的濃度(mol/L) | 滴定完成時,NaOH溶液滴入的體積(mL) | 待測鹽酸溶液的體積(mL) |
1 | 0.1000 | 30.05 | 20.00 |
2 | 0.1000 | 29.95 | 20.00 |
3 | 0.1000 | 28.20 | 20.00 |
①滴定達到終點的判斷是__。
②根據上述數據,可計算出該鹽酸的濃度約為___________(保留兩位小數)。
③排去堿式滴定管中氣泡的方法應采用操作______,然后輕輕擠壓玻璃球使尖嘴部分充滿堿液。
甲.![]() 乙.
乙.![]() 丙.
丙.![]()
④在上述實驗中,下列操作(其他操作正確)會造成鹽酸濃度測定結果偏高的有_____。
A.堿式滴定管使用前,水洗后未用NaOH標準溶液潤洗
B.錐形瓶水洗后未干燥
C.滴定前讀數時正確,滴定后俯視刻度線
D.堿式滴定管尖嘴部分有氣泡,滴定后消失
⑤如圖是某次滴定時的滴定管中的液面,其讀數為__________mL。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com