
科目: 來源: 題型:
【題目】t℃時,A的溶解度是Sg·100g-1,其飽和溶液密度為dg·cm-3、物質的量濃度為cmol·L-1。溶液的質量分數為w,A的摩爾質量為Mg·mol-1,實驗測得向一定量含A的溶液中加入mg無水A或蒸發掉ng水后恢復到t℃,均為飽和溶液,下列關系式正確的是( )
A.S=![]()
B.c=![]()
C.S=![]()
D.c%=![]() 100%
100%
查看答案和解析>>
科目: 來源: 題型:
【題目】化合物F是合成一種增強記憶力藥物的重要中間體,其合成路線如下:
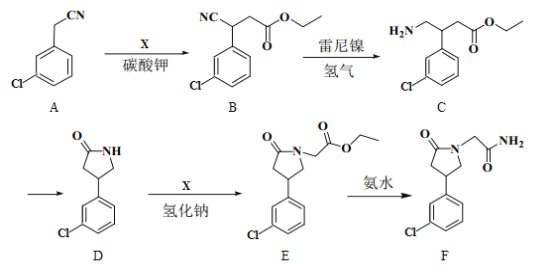
(1)E中的含氧官能團名稱為__________。(寫一種)
(2)A→B的反應類型為__________。
(3)寫出同時滿足下列條件的B的一種同分異構體的結構簡式:__________。
①為α-氨基酸;②苯環上有4個取代基;③有6種不同化學環境的氫。
(4)C轉為D生成的另一種產物的結構簡式為__________。
(5)已知:R—Br→R—CN,請寫出以苯甲醇(![]() )和
)和![]() 為原料制備有機物X
為原料制備有機物X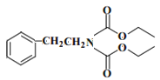 (結構如圖)的合成路線流程圖__________________(無機試劑任用,合成路線流程圖示例見本題題干)。
(結構如圖)的合成路線流程圖__________________(無機試劑任用,合成路線流程圖示例見本題題干)。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列反應中,硫酸既表現了氧化性又表現了酸性的是( )
A.2H2SO4(濃)+Cu![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
B.2H2SO4(濃)+C![]() CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
C.H2SO4(濃)+NaNO3![]() NaHSO4+HNO3↑
NaHSO4+HNO3↑
D.H2SO4+Na2SO3===Na2SO4+H2O+SO2↑
查看答案和解析>>
科目: 來源: 題型:
【題目】下列事實不能用勒夏特列原理解釋的是
A. 開啟啤酒瓶后,瓶中馬上泛起大量泡沫
B. 合成氨反應,為提高氨的產率,理論上應采取降低溫度的措施
C. 工業上生產硫酸的過程中使用過量的空氣以提高二氧化硫的利用率
D. 對于2HI(g)![]() H2(g)+I2(g),達平衡后,縮小容器體積可使體系顏色變深
H2(g)+I2(g),達平衡后,縮小容器體積可使體系顏色變深
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖中,甲是電解飽和食鹽水,乙是銅的電解精煉,丙是電鍍,回答:

(1)b極上的電極反應式為__,甲電池的總反應化學方程式是__。
(2)在粗銅的電解過程中,圖中c電極的材料是__(填“粗銅板”或“純銅板”);在d電極上發生的電極反應為__;若粗銅中還含有Au、Ag、Fe等雜質,則沉積在電解槽底部(陽極泥)的雜質是__,電解一段時間后,電解液中的金屬離子有__。
(3)如果要在鐵制品上鍍鎳(二價金屬,相對原子質量59),則f電極的材料是__(填“鐵制品”或“鎳塊”,下同),e電極的材料是__。
(4)若e電極的質量變化118 g,則a電極上產生的氣體在標準狀況下的體積為__。
查看答案和解析>>
科目: 來源: 題型:
【題目】廢鉛蓄電池的回收中產生大量的鉛膏,回收利用鉛膏能有效減少鉛污染,充分利用鉛資源。
(1)鉛膏制備PbO。鉛膏經過預處理后(主要成分為PbSO4)加入Na2CO3溶液,使之轉化為PbCO3,然后充分灼燒得到PbO。
①PbCO3分解產生aPbCO3bPbO中間產物。PbCO3和PbSO4加熱升溫過程中固體的質量變化見圖1。PbCO3在300 ℃時分解的產物為_____________。
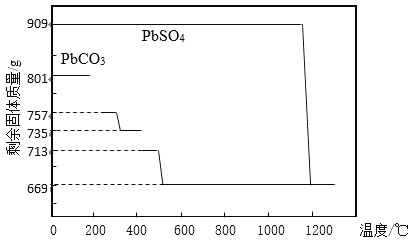
②工業上用PbCO3熱分解制備的PbO而不直接熱分解PbSO4制備的PbO的原因是_____________。
(2)沉淀除鉛。鉛膏經過轉化后得到含鉛的Na2SO4廢液,需要進一步除去廢水中的鉛。
①常溫下,該廢液中![]() 濃度為0.01 mol·L1,則該廢液中Pb2+濃度最大為_____________。[Ksp(PbSO4)=1.8×108]
濃度為0.01 mol·L1,則該廢液中Pb2+濃度最大為_____________。[Ksp(PbSO4)=1.8×108]
②隨溫度升高和![]() 濃度增大廢液中Pb2+濃度顯著增大,所以工業通常采用向廢液中加入Na2CO3、NaHCO3或NaOH等堿性沉淀劑產生Pb(OH)2沉淀除鉛。廢液隨著pH的變化生成Pb(OH)2的質量如圖2。向含鉛廢液中投放NaHCO3發生的離子方程式為_____________。在實際生產中采用NaHCO3或Na2CO3沉鉛,不采用NaOH的原因是_____________。
濃度增大廢液中Pb2+濃度顯著增大,所以工業通常采用向廢液中加入Na2CO3、NaHCO3或NaOH等堿性沉淀劑產生Pb(OH)2沉淀除鉛。廢液隨著pH的變化生成Pb(OH)2的質量如圖2。向含鉛廢液中投放NaHCO3發生的離子方程式為_____________。在實際生產中采用NaHCO3或Na2CO3沉鉛,不采用NaOH的原因是_____________。
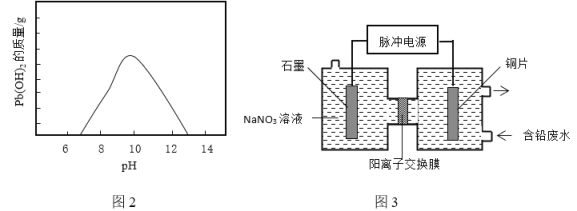
(3)電化學除鉛。利用脈沖電源(間歇性通入電流)電解法轉化廢液中的Pb2+實現鉛資源化利用,可以提高除鉛效率(除鉛效率與Pb2+濃度有關),其原理示意圖3。
①寫出陽極的電極反應式:__________。
②采用脈沖電解比普通電源電解的優點是__________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某小組按圖1所示的裝置探究鐵的吸氧腐蝕。
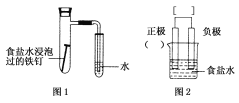
(1)圖2是圖1所示裝置的示意圖,在圖2的小括號內填寫正極材料的化學式_________;在方括號內用箭頭表示出電子流動的方向___________。
(2)正極反應式為_____________________,負極反應式為__________________。
(3)按圖1裝置實驗,約8 min時才看到導管中液柱上升,下列措施可以更快更清晰地觀察到液柱上升的是________。
a.用純氧氣代替具支試管內的空氣
b.將食鹽水浸泡過的鐵釘表面撒上鐵粉和碳粉的混合物
c.用毛細尖嘴管代替玻璃導管,并向試管的水中滴加少量紅墨水
查看答案和解析>>
科目: 來源: 題型:
【題目】每次取20 g海水,嚴格按照過濾、蒸發、冷卻、稱量、計算的實驗步驟規范操作,連續實驗三次,平均得固態鹽a g。該海水中含氯化鈉的質量分數是( )
A.大于5a%
B.小于5a%
C.等于5a%
D.無法判斷
查看答案和解析>>
科目: 來源: 題型:
【題目】黃銅礦是工業冶煉銅的原料,主要成分為CuFeS2。試回答下列問題:
(1)基態Cu原子的核外電子排布式為________;Cu、Zn的第二電離能大小I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(2)SO2分子中分子空間構型為________;與SO2互為等電子體的陰離子有________(寫一種)。
(3)[Cr(H2O)4Br2]Br·2H2O中心離子配位數為_______
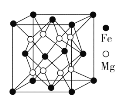
(4)鐵鎂合金是目前已發現的儲氫密度最高的儲氫材料之一,其晶胞結構如圖所示。晶胞距離Mg原子最近Mg數目為____________
查看答案和解析>>
科目: 來源: 題型:
【題目】鉛蓄電池是化學電源,其電極材料分別是Pb和PbO2,電解液為稀硫酸。工作時該電池總反應式為:Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)。根據上述情況判斷:
2PbSO4(s)+2H2O(l)。根據上述情況判斷:
(1)放電時,電解質溶液的pH________(填“增大”“減小”或“不變”)。
(2)放電時,電解質溶液中陰離子移向_____極,電子從_____極流向____極。
(3)寫出負極的電極方程式:_____________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com