
科目: 來源: 題型:
【題目】高錳酸鉀是錳的重要化合物和常用的氧化劑。如圖是在實驗室中制備KMnO4晶體的流程:
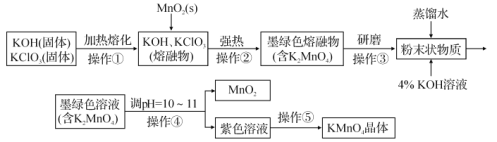
回答下列問題:
(1)在實驗流程中,操作①和②均需在坩堝中進行,根據實驗實際應選擇___(填序號)。
a.鐵坩堝 b.石英坩堝 c.瓷坩堝 d.氧化鋁坩堝
(2)“熔融物”中KClO3應過量的原因除了提高MnO2利用率外,還有_______。
(3)操作④是使K2MnO4轉化為KMnO4和MnO2,該轉化過程中發生反應的離子方程式為___。若溶液堿性過強,則![]() 又會轉化為
又會轉化為![]() ,同時產生無色氣體,該轉化過程中發生反應的離子方程式為___。
,同時產生無色氣體,該轉化過程中發生反應的離子方程式為___。
(4)還可采用電解K2MnO4溶液(綠色)的方法制備KMnO4(裝置如圖所示)。
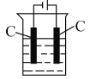
①電解過程中右側石墨電極的電極反應式為________。
②隨著電解的進行,溶液逐漸由綠色變為紫色。但若電解時間過長,溶液顏色又會轉變成綠色,可能原因是________。
③為避免該現象,請提出改進裝置的措施:________。
查看答案和解析>>
科目: 來源: 題型:
【題目】相同條件下,同質量的X、Y兩種氣體,相對分子質量分別為A、B;則:
(1)X與Y的體積比為_______,分子個數比為 _______,密度比為________;
(2)相同條件下的X、Y兩種氣體體積相同,則X與Y的質量比為_______,物質的量比為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】光刻膠是微電子技術中微細圖形加工的關鍵材料之一,其合成路線如下(部分試劑和產物已略去):
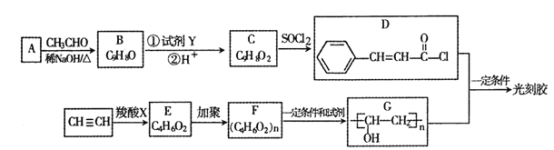
已知:I.![]() +
+ ![]()
![]()
![]() +H2O(R1,R2為烴基或氫)
+H2O(R1,R2為烴基或氫)
II.![]() +R2OH
+R2OH![]()
![]() +HCl(R1,R2為烴基)
+HCl(R1,R2為烴基)
(1)A的結構笱式________,B中所含官能團的名稱為_______。
(2)乙炔和羧酸X發生加成反應生成E,E能發生水解反應,則E的結構簡式為_______。
(3)B→C所需的試劑Y 和反應條件分別為 __________、____________;由F到G反應類型為______________。
(4)D和G反應生成光刻膠的化學方程式為________。
(5)T是C的同分異構體 T具有下列性質或特征:①能發生銀鏡反應和水解反應;②分子結構中除苯環外無其他環。則符合條件的T的結構有_______種,其中核磁共振氫譜為 5 組峰,且峰面積比為1:1:2: 2所有的結構簡式為 ______。
查看答案和解析>>
科目: 來源: 題型:
【題目】海洋植物如海帶、海藻中含有豐富的碘元素,碘元素以碘離子的形式存在。實驗室里從海藻中提取碘的流程如下(已知2KI+Cl2===2KCl+I2,碘與溴一樣易溶于有機溶劑):
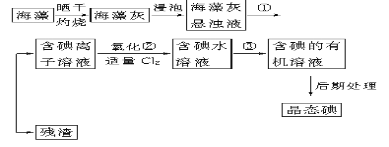
(1)指出提取碘的過程中有關的實驗操作名稱:①________,③_____________。
(2)提取碘的過程中,可供選擇的有機試劑是____________。
A.苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、酒精
(3)為使海藻灰中碘離子轉化為碘的有機溶液,實驗室里有燒杯、玻璃棒、集氣瓶、酒精燈、導管、圓底燒瓶、石棉網以及必要的夾持儀器、物品,尚缺少的玻璃儀器是_______。
(4)從含碘的有機溶液中提取碘和回收有機溶劑,還需經過蒸餾,指出下圖所示實驗裝置中的錯誤之處:
① ________________________ ②_______________________________ 、③_________

查看答案和解析>>
科目: 來源: 題型:
【題目】某校化學研究小組會試對校園附近空氣質量進行測定請回答下列問題。
(1)甲組同學設計了如圖所示的實驗裝置,對空氣中SO2、懸浮顆粒物含量進行測定。下列裝置連接的順序為(填序號 )________________。

注:氣體流速管是用來測量單位時間內通過氣體的體積的裝置
①用上述裝置定量測定空氣中的SO2和可吸入顆粒的含量,除測定氣體流速(單位:cm3·min-1)外還需要測定____________、____________。
②已知:碘單質微溶于水,KI可以增大碘在水中的溶解度。請你協助甲組同學完成100mL 5×10-4mo1 L-1碘溶液的配制:
第一步:用電子天平準確稱取1.27g碘單質加入燒杯中,______________。
第二步:將第一步所得溶液和洗滌液全部轉入_____ mL的容量瓶中,加水定容,搖勻。
第三步:從第二步所得溶液中取出10.00mL溶液倒入100mL容量瓶中,加水稀釋至刻度線,搖勻。
(2)乙組同學擬用如圖簡易裝置測定空氣中的SO2含量:

①檢查該裝置的氣密性時,先在試管中裝入適量的水(保證玻璃管的下端浸沒在水中)。然后__________(填寫操作方法)時。將會看到_____________(填寫實驗現象),則證明該裝置的氣密性良好。
②測定指定地點空氣中的SO2含量準確移取1.00mL 5×10-4mo1L-1碘溶液,注入如圖所示試管中。用適量的蒸餾水桸釋后,再加2~3滴淀粉溶液,配制成溶液A。甲、乙兩組同學分別使用如圖所示相同的實驗裝置和溶液A,在同一地點、同時推拉注射器的活塞,反復抽氣,直到溶液的藍色全部褪盡為止停止抽氣,記錄抽氣次數如下(假設每次抽氣500mL)。
分組 | 甲組 | 乙組 |
抽氣次數 | 110 | 145 |
我國環境空氣質量標準對空氣質量測定中SO2的最高濃度限值如下表:
最高濃度限值/mg·m-3 | ||
一級標準 | 二級標準 | 三級標準 |
0.15 | 0.50 | 0. 70 |
經老師和同學們分析,判斷甲組測定結果更為準確,則該地點的空氣中SO2 的含量為_______mgm-3(保留2 位有效數字),屬于________(填漢字)級標準;請你分析乙組實驗結果產生較大偏差的原因是(兩個小組所用裝置和藥品均無問題)______________。
查看答案和解析>>
科目: 來源: 題型:
【題目】飲用水的質量關系到關系到每個人的健康,因含有一定濃度的NO3-將對人類健康產生危害,NO3-能氧化人體血紅蛋白中的Fe(II),使其失去攜氧功能,為了降低飲用水中NO3-的濃度,某興趣小組提出如圖方案:
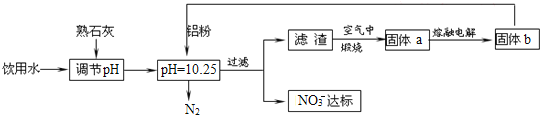
請回答下列問題:
(1)人體血液中如果缺乏亞鐵離子,就會造成缺鐵性貧血。市場出售的某種麥片中含有微量、顆粒細小的還原鐵粉,這些鐵粉在人體胃酸(胃酸的主要成分是HCl)作用下轉化成亞鐵鹽。寫出該反應的離子方程式:____。
(2)已知過濾后得到的濾渣是一種混合物,則在溶液中鋁粉和NO3-反應的離子方程式為__。
(3)該方案中選用熟石灰調節pH,理由是___、___。
(4)用H2催化還原法也可降低飲用水中NO3-的濃度,已知反應中的還原產物和氧化產物均可參與大氣循環,則催化還原法的離子方程式為___。
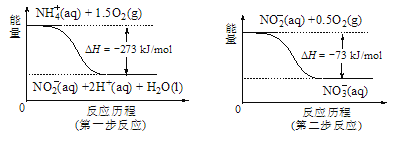
(5)飲用水中的NO3-主要來自于NH4+。已知在微生物作用的條件下,NH4+經過兩步反應被氧化成NO3-。兩步反應的能量變化示意圖如圖,試寫出1molNH4+(aq)全部氧化成NO3-(aq)的熱化學方程式是____。
查看答案和解析>>
科目: 來源: 題型:
【題目】據報道,德國科學家實現了銣原子氣體超流體態與絕緣態的可逆轉換,該成果將給量子計算機的研究帶來重大突破。已知銣是37號元素。根據相關知識回答下列問題:
(1)銣(Rb)位于元素周期表的第________周期________族。
(2)關于銣的結構和性質判斷正確的是________(填序號)。
①與水反應比鈉劇烈
②它的原子半徑比鈉小
③它的氧化物暴露在空氣中易吸收CO2
④它的陽離子最外層電子數和鎂相同
⑤它是還原劑
(3)現有銣和另一種堿金屬形成的合金50 g,當它與足量水反應時,放出標準狀況下的氫氣22.4 L,這種堿金屬可能是________(填序號)。
a.Li b.Na
c.K d.Cs
查看答案和解析>>
科目: 來源: 題型:
【題目】已知X、Y、Z、W、M、N為短周期元素且原子序數依次增大,X與M、W與N分別同主族,且元素X、Y、Z、W分屬兩個短周期,它們四者原子序數之和為22,最外層電子數之和為16,在18電子的化合物Y2X6、Z2X4、X2W2中,相應分子內各原子最外層電子都滿足穩定結構,請回答下列問題:
(1)Y元素在周期表中的位置是___,Y2X6所含有的化學鍵類型是___。
(2)寫出X2W2的電子式___;Z2X4結構式___。
(3)用電子式描述M2N化合物的形成程_____。
(4)均含X、W、M、N四種元素的兩種化合物相互反應有刺激性氣味氣體放出,反應的離子方程式為____。
(5)火箭發動機曾經利用Z2X4作燃料X2W2作助燃劑,產物環保無污染,寫出二者反應的方程式____。
(6)熔融鹽燃料電池具有高的發電效率,可用Li2CO3和Na2CO3的熔融鹽混合物作電解質,YW為負極燃氣,空氣和YW2的混合氣體為正極助燃氣,制得在650℃下工作的燃料電池。電池工作時的負極反應式為:____。
查看答案和解析>>
科目: 來源: 題型:
【題目】二烯烴與溴反應制備多鹵代物,反應的區域選擇性在有機合成中具有重要意義。1,3–丁二烯(g) (CH2=CH—CH=CH2)和Br2(g)反應原理如下:
①CH2=CH-CH=CH2(g)+Br2(g)→![]() (g) △H1=akJ·mol-1
(g) △H1=akJ·mol-1
②CH2=CH-CH=CH2(g)+Br2(g)→ (g) △H2=bkJ·mol-1
(g) △H2=bkJ·mol-1
③![]() (g)
(g) (g) △H3
(g) △H3
回答下列問題:
(1)△H3=_____________。
(2)1,3-丁二烯和Br2反應的能量隨反應過程的變化關系如圖所示:

1,3-丁二烯和Br2反應會生成兩種產物,一種稱為動力學產物,由速率更快的反應生成;一種稱為熱力學產物,由產物更加穩定的反應生成。則動力學產物結構簡式為_________
(3)T℃時在2L剛性密閉容器中充入1,3-丁二烯(g)(CH2=CH-CH=CH2)和Br2(g)各2mol,發生反應。1,3-丁二烯及產物的物質的量分數隨時間的變化如下表:
時間(min) | 0 | 10 | 20 | 30 | 40 |
1,3-丁二烯 | 100% | 72% | 0% | 0% | 0% |
1,2加成產物 | 0% | 26% | 10% | 4% | 4% |
1,4加成產物 | 0% | 2% | 90% | 96% | 96% |
在0 ~20min內,反應體系中1,4-加成產物的平均反應速率v(1,4加成產物)=_______。
(4)對于反應③,若要提高1,4-加成產物 ( )平衡體系中的物質量分數,可以采取的措施有_____
)平衡體系中的物質量分數,可以采取的措施有_____
A.適當升高溫度 B.使用合適的催化劑
C.增大體系的壓強 D.將1,4加成產物及時從體系分離
(5)反應 1,3-丁二烯二聚體的解聚為可逆反應:
 (g)
(g)![]() 2
2![]() (g) △H>0
(g) △H>0
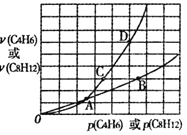
在一定條件下,C4H6和C8H12的消耗速率與各自分壓有如下關系:v(C8H12)=k1·p(C8H12),v(C4H6)=k2·p2(C4H6)。相應的速率與其分壓關系如圖所示,一定溫度下k1、k2與平衡常數Kp(壓力平衡常數,用平衡分壓代替平衡濃度計算)間的關系是k1=_____;在圖中標出點(A、B、C、D)中,能表示反應達到平衡狀態的點是______ ,理由是________。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知元素aA、bB、cC、dD、eE的原子結構示意圖分別為
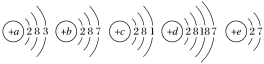
請回答下列問題:
(1)屬于同周期的元素是________(填元素符號,下同),屬于同主族的元素是________。
(2)金屬性最強的元素是________,非金屬性最強的元素是________。
(3)上述元素中最高價氧化物對應的水化物堿性最強的是________(填化學式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com