
科目: 來源: 題型:
【題目】化學實驗中常將溶液或試劑進行酸化,下列酸化處理的措施正確的是( )
A.檢驗溶液是否含有SO![]() 時,先用鹽酸將待檢驗溶液酸化,然后往其中滴加BaCl2溶液
時,先用鹽酸將待檢驗溶液酸化,然后往其中滴加BaCl2溶液
B.為提高高錳酸鉀溶液的氧化能力,用鹽酸將高錳酸鉀溶液酸化
C.檢驗溶液中是否含有Fe3+時,用硝酸酸化
D.定性檢驗SO![]() ,將BaCl2溶液用HNO3酸化
,將BaCl2溶液用HNO3酸化
查看答案和解析>>
科目: 來源: 題型:
【題目】下表為元素周期表的一部分,表中所列的字母分別代表一種化學元素。

(1)a、b、c三種元素的原子半徑由大到小的順序是___(填元素符號);b、f、h三種元素對應簡單氫化物的熱穩定性由強到弱的順序是___(填化學式)。
(2)c、d、e三種元素最高價氧化物對應水化物中堿性最強的是___(填水化物的化學式)。
(3)利用如圖裝置可比較a、e、h的非金屬性強弱,則裝置中試劑X、Z分別為___(填化學式)。
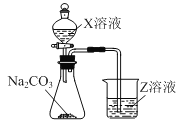
(4)元素i的原子結構示意圖為___;寫出元素i的最高價氧化物對應水化物溶液與元素d的單質反應的離子方程式___。
(5)推測原子序數為34的元素在周期表中的位置___。
查看答案和解析>>
科目: 來源: 題型:
【題目】氮化鎂(Mg3N2)是一種高強度鋼冶煉的添加劑,現某學習小組利用下列裝置制備少量氮化鎂。
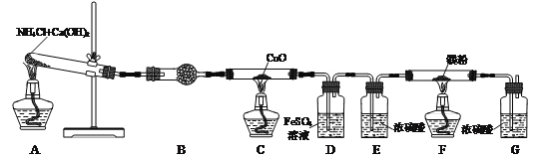
已知:Ⅰ.3Mg+N2![]() Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
(1)檢查該裝置氣密性的方法是___。
(2)寫出裝置A中發生反應的化學方程式:___,裝置B中試劑的名稱是___。
(3)反應一段時間后裝置C中黑色固體變為紅色,并有水珠出現。裝置C中發生反應的化學方程式為___。
(4)裝置D中FeSO4溶液的作用是___。
(5)實驗過程中裝置A和F應該先加熱的是___處。
(6)裝置F中有氮化鎂生成,寫出通過實驗驗證氮化鎂生成的操作及現象:取少量裝置F反應后的固體于試管中,___,說明其中含氮化鎂。
查看答案和解析>>
科目: 來源: 題型:
【題目】X、Y、Z、W、R屬于周期表中前20號主族元素,且原子序數依次增大。元素X的單質是空氣中體積分數最大的氣體,Z是元素周期表中非金屬性最強的元素,Z和W是同族元素,R的最外層電子數是最內層電子數的一半。下列說法正確的是( )
A.元素X和Y形成的化合物均為無色氣體
B.元素Z、W的最高正價均為+7價
C.X的氫化物與W的氫化物相遇會生成白煙
D.化合物R2Y2中陽離子和陰離子比例為1∶1
查看答案和解析>>
科目: 來源: 題型:
【題目】目前工業上可利用CO或CO2來生產燃料甲醇,某研究小組對下列有關甲醇制取的三條化學反應原理進行探究。已知在不同溫度下的化學反應平衡常數(K1、K2、K3)如表所示。請回答下列問題:
化學反應 | 焓變 | 平衡常數 | 溫度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
(1)反應②是____(填“吸熱”或“放熱”)反應。
(2)根據反應①與②可推導出K1、K2與K3之間的關系,則K3=____(用K1、K2表示);根據反應③判斷ΔS___0(填“>”、“=”或“<”),在____(填“較高”或“較低”)溫度下有利于該反應自發進行。
(3)500℃時,測得反應③在某時刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的濃度分別為0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,則此時v(正)___v(逆)(填“>”、“=”或“<”)。
(4)根據上述表格測得焓變,下列能量關系圖合理的是_____
A. B.
B.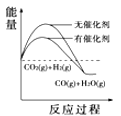 C.
C.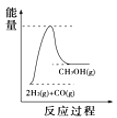 D.
D.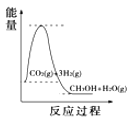
查看答案和解析>>
科目: 來源: 題型:
【題目】2020年2月17日下午,在國務院聯防聯控機制發布會上,科技部生物中心副主任孫燕榮告訴記者:磷酸氯喹對“COV1D-19”的治療有明確的療效,該藥是上市多年的老藥,用于廣泛人群治療。其合成路線如下所示:

巳知:醛基在一定條件下可以還原成甲基。
回答下列問題:
(1)A中含氧官能團的名稱為_____。
(2)下列說法中正確的是_____(填序號)。
a.可用新制氫氧化銅濁液鑒別開有機物A和D
b.物質D和E是同分異構體
c.可用紅外光譜儀測定物質C的相對分子質量
d.由C生成D發生的是水解反應
(3)反應⑩的反應類型為_____,反應⑤若溫度過高會發生副反應,請寫出一個可能發生的副反應的化學方程式_____。
(4)碳原子上連有4個不同的原子或基團時,該碳原子稱為手性碳。磷酸氯喹(L)分子中有_____個手性碳。
(5)有機物E有多種同分異構體,其中屬于酯的有_____種,在屬于羧酸的同分異構體中,有一種核磁共振氫譜有兩組峰,其結構簡式為_____。
(6)以2一丙醇和必要的試劑合成2—丙胺[CH3CH(NH2)CH3]:_____(用箭頭表示轉化關系,箭頭上注明試劑)。
查看答案和解析>>
科目: 來源: 題型:
【題目】氨基甲酸銨(NH2COONH4)是一種易分解、易水解的白色固體、難溶于CCl4。實驗室可將干燥二氧化碳和氨氣通入CCl4中進行制備,反應原理為2NH3(g)+CO2(g)=NH2COONH4(s) △H<0,回答下列問題:
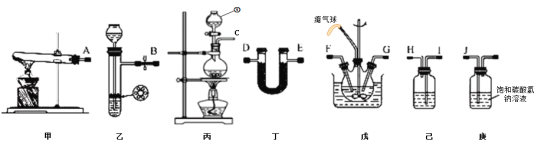
(1)儀器①的名稱為_____,裝置己中盛放的試劑為_____。
(2)簡述檢驗裝置乙氣密性的操作_____。
(3)氨氣的發生裝置可以選擇上圖中的_____,制取氨氣的化學方程式為_____。
(4)預制備產品,選擇上圖中必要的裝置,其連接順序為:發生裝置→_____→FG←_____←KJ←_____(按氣流方向,用大寫字母表示)。
(5)為了提高氨基甲酸銨的產率.對三頸瓶采取的控溫方法是_____,反應結束后,從反應后的混合物中分離出產品的實驗操作是_____,戊中氣球的作用是_____。
(6)氨基甲酸銨容易變質生成碳酸氫銨,現取長期存放的樣品19.550g,用足量石灰水處理后,使樣品中碳元素完全轉化為碳酸鈣,通過系列操作得純凈碳酸鈣25.000g,則該樣品的純度為_____%。(計算結果保留三位有效數字;有關物質的相對式量:氨基甲酸銨78、碳酸氫銨79、碳酸鈣100) 。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列說法正確的是( )
A.9g水中含有的原子總數為1.5×6.02×1023
B.1.0mol·L-1氯化鎂溶液中含有Cl-數為2.0×6.02×1023
C.標準狀況下,11.2L四氯化碳中含有的分子數為0.5×6.02×1023
D.鈉與水反應時,每反應0.1mol鈉,轉移電子數為0.2×6.02×1023
查看答案和解析>>
科目: 來源: 題型:
【題目】某興趣小組利用廢銅屑(含銅、鋁等)制備CuSO4·5H2O晶體,制備流程如圖:
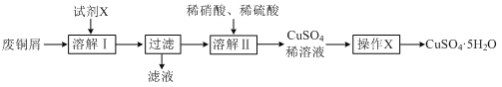
(1)“溶解Ⅰ”過程中所用試劑X為___。(填寫試劑名稱)
(2)“溶解Ⅱ”發生反應的離子方程式為___。
(3)“操作X”包括___、過濾、無水乙醇洗滌、低溫干燥。
(4)某種殺菌劑中含CuSO4和Cu(OH)2,為測定其組成,興趣小組設計如下實驗:取一定量的殺菌劑,將其溶于足量的稀鹽酸中,然后向其中加入足量的BaCl2溶液,過濾干燥后得白色固體2.33g。然后向濾液中滴加1.00mol·L-1的Na2H2Y(EDTA)溶液,反應至終點時消耗Na2H2Y溶液30.00 mL(離子方程式為Cu2++H2Y2-=CuY2-+2H+)。
①由準確稱量后的EDTA固體配制100mL1.00mol·L-1的EDTA溶液所需的玻璃儀器除燒杯、膠頭滴管外還有___。
②通過計算確定殺菌劑中CuSO4和Cu(OH)2的物質的量之比___(寫出計算過程)。
查看答案和解析>>
科目: 來源: 題型:
【題目】我國化學家合成的鉻的化合物,通過烷基鋁和[ph3C]+[B(C6F5)4]-活化后,對乙烯聚合表現岀較好的催化活性。合成銘的化合物過程中一步反應如下,該反應涉及H、C、N、O、Cl、Cr等多種元素。

回答下列問題:
(1)下列狀態的氯中,電離最外層一個電子所需能量最大的是_____________(填標號)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)化合物乙中碳原子采取的雜化方式為______,化合物丙中a、b、n、m處的化學鍵是配位鍵的是______(填字母)處。
(3)Cr3+具有較強的穩定性,Cr3+的核外電子排布式為______;已知沒有未成對d電子的過渡金屬離子形成的水合離子是無色的,Ti4+、V3+、Ni2+三種離子的水合離子為無顏色的是______(填離子符號)。
(4)ClO3-的鍵角小于ClO4-的鍵角,原因是______。
(5)根據結構與性質的關系解釋,HNO2的酸性比HNO3弱的原因:______。
(6)水在合成鉻的化合物的過程中作溶劑。研究表明水能凝結成13種類型的結晶體。其中重冰(密度比水大)屬于立方晶系,其立方晶胞沿x、y、z軸的投影圖如圖所示,晶體中的H2O配位數為_____晶胞邊長為a pm,則重冰的密度為 ____g·cm-3(寫出數學表達式,NA為阿伏伽徳羅常數)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com