
科目: 來源: 題型:
【題目】(1)25時℃,0.2 mol/L的HF溶液中存在下述平衡:HF![]() H++F-。加一定量的蒸餾水,平衡將____(填“正向”、“逆向”或“不”)移動,溶液中的c(H+)將___(填“增大”、“減小”或“不變”);加入少量0.2mol/L的鹽酸,能___(填“促進”或“抑制”)HF的電離,HF的電離平衡常數K將___(填“增大”、“減小”或“不變”);
H++F-。加一定量的蒸餾水,平衡將____(填“正向”、“逆向”或“不”)移動,溶液中的c(H+)將___(填“增大”、“減小”或“不變”);加入少量0.2mol/L的鹽酸,能___(填“促進”或“抑制”)HF的電離,HF的電離平衡常數K將___(填“增大”、“減小”或“不變”);
(2)下列物質屬于電解質的是____;屬于非電解質的是____;能導電的物質是____;其水溶液能夠導電的物質____。
①CO2 ②銅 ③燒堿 ④NH3.H2O ⑤石墨 ⑥碳酸鈉 ⑦CH3COOH ⑧蔗糖 ⑨氯氣 ⑩鹽酸
查看答案和解析>>
科目: 來源: 題型:
【題目】某實驗小組設計用50mL1.0 mol/L鹽酸跟50mL1.1mol/L氫氧化鈉溶液在如圖裝置中進行中和反應。在大燒杯底部墊泡沫塑料(或紙條),使放入的小燒杯杯口與大燒杯杯口相平。然后再在大、小燒杯之間填滿碎泡沫塑料(或紙條),大燒杯上用泡沫塑料板(或硬紙板)作蓋板,在板中間開兩個小孔,正好使溫度計和環形玻璃攪拌棒通過。通過測定反應過程中所放出的熱量可計算中和熱。試回答下列問題:
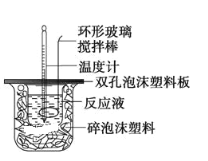
(1)本實驗中用稍過量的NaOH的原因教材中說是為保證鹽酸完全被中和。試問:鹽酸在反應中若因為有放熱現象,而造成少量鹽酸在反應中揮發,則測得的中和熱___(填“偏大”“偏小”或“不變”)。
(2)該實驗小組做了三次實驗,每次取溶液各50 mL,并記錄如下原始數據。
實驗序號 | 起始溫度t1/℃ | 終止溫度t2/℃ | 溫差(t2-t1)/℃ | ||
鹽酸 | NaOH溶液 | 平均值 | |||
1 | 24.8 | 25.2 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.2 | 25.0 | 25.1 | 31.9 | 6.8 |
已知鹽酸、NaOH溶液密度近似為1.00g/cm3,中和后混合液的比熱容c=4.18×10-3 kJ/(g·℃),混合后溶液質量為m,反應放出的熱量Q=cm△t,則該反應生成水的物質的量為____,中和熱為ΔH=____。
(3)若用等濃度的鹽酸與NH3·H2O溶液反應,則測得的中和熱會___(填“偏大”“偏小”或“不變”),其原因是____。
(4)在中和熱測定實驗中存在用水洗滌溫度計上的鹽酸溶液的步驟,若無此操作步驟,則測得的中和熱____(填“偏大”“偏小”或“不變”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】某小組同學為探究H2O2、H2SO3、Br2氧化性強弱,設計如下實驗(夾持儀器已略去,裝置的氣密性已檢驗)。
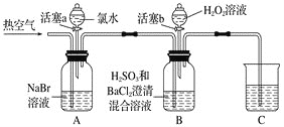
實驗記錄如下:
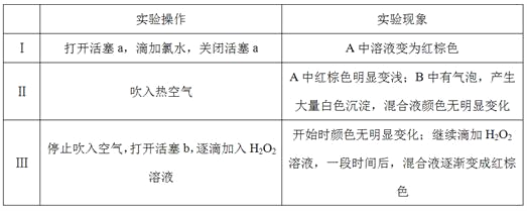
請回答下列問題:
(1)A中反應的離子方程式是__________________________________________________。
(2)實驗操作Ⅱ吹入熱空氣的目的是_________________________________________。
(3)裝置C的作用是____________,C中盛放的藥品是_____________。
(4)實驗操作Ⅲ,混合液逐漸變成紅棕色,其對應的離子方程式_______________________。
(5)由上述實驗得出的結論是_________________________________________________。
(6)實驗反思:
①有同學認為實驗操作Ⅱ吹入的熱空氣,會干擾(5)中結論的得出,你認為是否干擾,理由是_____________________________________________________________________。
②實驗操作Ⅲ,開始時顏色無明顯變化的原因是(寫出一條即可):____________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)鐵釘在氯氣中被銹蝕為棕褐色物質FeCl3,而在鹽酸中生成淺綠色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最強的是____________。
(2)鹽酸在不同的反應中可以分別表現出酸性、氧化性和還原性。現在有如下三個反應,請寫出鹽酸在三個反應中分別起何種作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)鐵釘在氯氣中被銹蝕成棕褐色物質FeCl3,而在鹽酸中生成淺綠色溶液(FeCl2);向濃鹽酸中滴加KMnO4溶液產生淡黃綠色氣體(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最強。
中,__________________氧化性最強。
(4)高錳酸鉀與氫溴酸溶液可以發生下列反應:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中還原劑是________________。若消耗15.8 g氧化劑,則被氧化的還原劑的質量是______________g。HBr的作用是____________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】設![]() 為阿伏加德羅常數的值。下列說法不正確的是( )
為阿伏加德羅常數的值。下列說法不正確的是( )
A.![]() 與過量濃硝酸反應,收集到
與過量濃硝酸反應,收集到![]() 氣體(標準狀況),則被還原的硝酸的數目是0.06NA
氣體(標準狀況),則被還原的硝酸的數目是0.06NA
B.常溫常壓下,![]() 的乙二酸溶液中,總的離子數目大于0.15NA
的乙二酸溶液中,總的離子數目大于0.15NA
C.常溫常壓下,![]() 與足量
與足量![]() 反應,共生成
反應,共生成![]() 轉移電子的數目為0.4NA
轉移電子的數目為0.4NA
D.含![]() 與
與![]() 共
共![]() 的溶液中,N(
的溶液中,N(![]() )+N
)+N![]() )+N(H2CO3)=NA
)+N(H2CO3)=NA
查看答案和解析>>
科目: 來源: 題型:
【題目】一定溫度下,定容密閉容器中0.4mol/LN2,1mol/LH2進行反應:N2(g)+ 3H2(g)![]() 2NH3(g),10min反應達到平衡,此時測得N2濃度為0.2mol/L。
2NH3(g),10min反應達到平衡,此時測得N2濃度為0.2mol/L。
(1)10min內,用H2濃度變化來表示的反應速率為___,平衡時NH3的物質的量濃度為____;
(2)能判斷該反應達到化學平衡狀態的依據是____
A.容器中密度不隨時間變化而變化 B.容器中各物質的濃度保持不變
C.N2和NH3的消耗速率之比為2∶1 D.N2消耗速率與H2生成速率之比為3:1
(3)平衡時N2和H2的轉化率之比為____;該反應的平衡常數表達式為K=____,該溫度下反應的平衡常數是___。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知:①N2(g)+2O2(g)![]() 2NO2(g) △H=+67.7kJ/mol
2NO2(g) △H=+67.7kJ/mol
②2N2H4(g)+2O2(g)![]() 2N2(g)+4H2O(g) △H=-1068kJ/mol
2N2(g)+4H2O(g) △H=-1068kJ/mol
(1)火箭發射時可用肼(N2H4)作燃料,以二氧化氮作氧化劑,它們相互反應生成氮氣和水蒸氣。根據蓋斯定律寫出N2H 4和NO2反應的熱化學方程式為____;
(2)肼(N2H4)和氧氣反應的能量變化如圖所示,圖中E1表示___,E2表示____,△H=-534kJ/mol表示_____。

查看答案和解析>>
科目: 來源: 題型:
【題目】亞鐵鹽、鐵鹽在工農業生產、生活、污水處理等方面有著極其廣泛的應用,現用鐵屑與硫酸反應制備硫酸亞鐵。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
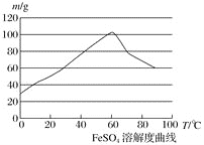
②硫酸亞鐵在水中的溶解度如下圖:
(1)首先,將鐵屑放入碳酸鈉溶液中煮沸除油污,分離出液體,用水洗凈鐵屑。此步驟中,分離出液體的方法通常不用過濾,使用的操作是____________(填寫操作名稱)。
(2)向處理過的鐵屑中加入適量的硫酸,在一定溫度下使其反應到不再產生氣體,趁熱過濾,得硫酸亞鐵溶液。
①硫酸濃度應選擇(填字母序號)__________;
A.濃硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意濃度硫酸
②溫度宜控制在________,加熱的同時需適當補充水,原因是___________________;
③反應中應保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亞鐵鹽在空氣中易被氧化,但形成復鹽可穩定存在,如“摩爾鹽”,即(NH4)2SO4·FeSO4·6H2O(硫酸亞鐵銨),就是在硫酸亞鐵溶液中加入少量稀硫酸溶液,再加入飽和硫酸銨溶液,經過_______、_______、_______、_______等一系列操作后所得。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列物質在水中的電離方程式書寫正確的是( )
A.H2CO3![]() 2H++CO32-B.Al(OH)3=Al3+ +3OH-
2H++CO32-B.Al(OH)3=Al3+ +3OH-
C.NH3·H2O![]() NH4+ +OH-D.NaHSO4=Na++HSO4-
NH4+ +OH-D.NaHSO4=Na++HSO4-
查看答案和解析>>
科目: 來源: 題型:
【題目】按要求填空。
(1)根據反應Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O,氧化劑與還原劑的物質的量之比是_____,當有2molHNO3參加反應時,被氧化的物質是____g,電子轉移數目約為_____個。
(2)在反應K2S+4H2SO4(濃)![]() K2SO4+4SO2↑+4H2O中,氧化產物是____,還原產物是______,氧化劑與還原劑物質的量之比是_____。
K2SO4+4SO2↑+4H2O中,氧化產物是____,還原產物是______,氧化劑與還原劑物質的量之比是_____。
(3)某同學寫出以下三個化學方程式:(未配平)
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你認為不可能實現的是______。
(4)今有下列三個氧化還原反應:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O
氧化性最強的物質的是____(填字母,下同),若某溶液中有Fe2+、I-、Cl-共存,要將I-氧化除去而不氧化Fe2+和Cl-,則可加入的試劑是____。
A.Cl2 B.KMnO4 C.FeCl3 D.I2
(5)30mL濃度為0.05mol·L-1的Na2SO3溶液恰好與25mL濃度為0.02mol·L-1的K2R2O7溶液反應,則元素R在還原產物中的化合價是_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com