
科目: 來源: 題型:
【題目】氮及其化合物的性質是了解工農業生產的重要基礎。設NA為阿伏加德羅常數的值,下列有關說法錯誤的是( )
A.標準狀況下,5.6LNO與5.6LO2充分混合后的分子數為0.5NA
B.標準狀況下,22.4L15NH3含有的質子數為10NA
C.13.8gNO2與足量水反應,轉移的電子數為0.2NA
D.常溫下,1L0.1mol·L1NH4NO3溶液中含有的氮原子數為0.2NA
查看答案和解析>>
科目: 來源: 題型:
【題目】鉍酸鈉(NaBiO3)常用作Mn2+鑒定的強氧化劑,某研究小組用浮選過的輝鉍礦(主要成分是Bi2S3,還含少量Bi2O3、SiO2等雜質)制備鉍酸鈉,其流程如圖:
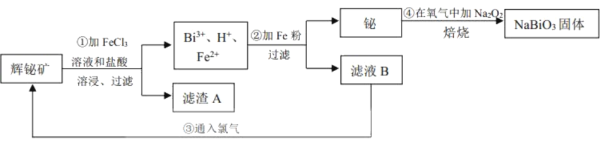
己知:①NaBiO3是一種難溶于水的物質
②BiCl3極易水解生成不溶性的BiOCl沉淀
請回答下列問題:
(1)為了提高溶浸工序中原料的浸出率,可以采取的措施有___(填標號)。
a.加入足量的蒸餾水 b.攪拌 c.粉碎礦石 d.降低溫度
(2)溶浸時通常加入FeCl3溶液和濃鹽酸,加入的濃鹽酸需過量的目的是___,濾渣A的主要成分為___(填化學式)。
(3)反應④的化學方程式為___。
(4)NaBiO3可在酸性介質中將Mn2+氧化為MnO![]() ,故可用于Mn2+的鑒定。已知NaBiO3被還原為Bi3+,該反應的離子方程式為___。
,故可用于Mn2+的鑒定。已知NaBiO3被還原為Bi3+,該反應的離子方程式為___。
(5)實驗室為了測定NaBiO3樣品的純度,需要配制250mL0.500mol/LFeSO4溶液,所需要的玻璃儀器除燒杯、量筒、玻璃棒外,還需要___。
(6)取上述NaBiO3樣品10.0g,加入稀硫酸和MnSO4溶液使其完全溶解,稀釋至100mL,取出20.00mL溶液,然后用新配制的0.500mol/LFeSO4溶液進行滴定,滴定完成后消耗24.80mLFeSO4溶液。則該樣品中NaBiO3純度為___%(結果保留小數點后一位)。
查看答案和解析>>
科目: 來源: 題型:
【題目】利用生產麥芽酚廢渣[主要含Mg(OH)Br,以及少量NH4Cl和不溶于水的有機溶劑等]制取溴乙烷的實驗流程如圖:
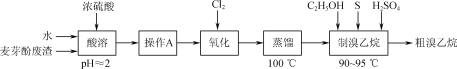
(1)“酸溶”時,水與廢渣的質量比約為2∶1,加水量不宜過少的原因是___。
(2)“操作A”的名稱是____。
(3)“蒸餾”出Br2時,最適合的加熱方法是____。
(4)“制溴乙烷”的裝置如圖所示:
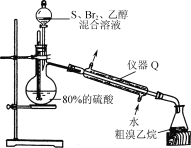
①圖中儀器Q的名稱是____。
②燒瓶中生成溴乙烷、硫酸的化學方程式為___。
(5)設計將粗溴乙烷進行純化的實驗方案:___,得純凈干燥的溴乙烷[實驗中必須使用的試劑:蒸餾水、無水CaCl2、1%的NaOH溶液]。
查看答案和解析>>
科目: 來源: 題型:
【題目】某化學興趣小組在實驗室中探究Ti、Mg、Cu的活潑性順序。他們在相同溫度下,取大小相同的三種金屬薄片,分別投入等體積等濃度的足量稀鹽酸中,現象如下:

下列有關三種金屬的說法中正確的是( )
A.三種金屬的活潑性由強到弱的順序是Ti、Mg、Cu
B.若鈦粉中混有Mg,提純Ti時可用稀鹽酸除去Mg
C.用Ti從CuSO4溶液中置換出Cu是工業制取Cu的很好途徑
D.Cu和MgCl2溶液不發生化學反應
查看答案和解析>>
科目: 來源: 題型:
【題目】下列有關鈉的化合物說法正確的是( )
A. 將NaOH濃溶液滴加到飽和FeCl3溶液中制備Fe(OH)3膠體
B. 用加熱法除去NaHCO3固體中混有的Na2CO3
C. 灼燒白色粉末,火焰呈黃色,證明原粉末中有Na+,一定沒有K+
D. Na2O2可用于呼吸面具中氧氣的來源
查看答案和解析>>
科目: 來源: 題型:
【題目】在下列物質的轉化關系中,A是一種固體單質,且常作半導體材料,E是一種白色沉淀,F是最輕的氣體單質。
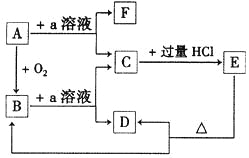
據此填寫:
(1)B的化學式是____________,目前在現代通迅方面B已被用作_____________主要原料。
(2)B和a溶液反應的離子方程式是_____________________。
(3)A和a溶液反應的離子方程式是_____________________。
(4)C和過量鹽酸反應的離子方程式是____________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】硼的化合物或合金在儲氫、有機合成、超導等方面用途非常廣泛。
(1)Mn(BH4)2是一種儲氫材料,Mn2+基態核外電子排布式為___。
(2)與環硼氮六烷[分子式為(HNBH)3]互為等電子體的常見分子是___(填結構簡式);推測環硼氮六烷在熱水、CH3OH中的溶解性:__(填“難”或“易”)溶于熱水、CH3OH。
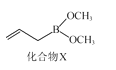
(3)化合物X(如圖所示)可由CH2CHCH2MgBr與B(OCH3)3制備。X分子中碳原子的軌道雜化類型為___;1molX分子中含σ鍵數目為____。
(4)YxNiyBzCw在臨界溫度15.6K時可實現超導,其晶胞結構如圖所示,則其化學式為___。
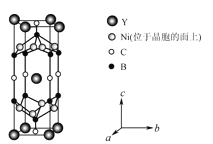
查看答案和解析>>
科目: 來源: 題型:
【題目】鋁粉和氧化鐵粉末的混合物制成的鋁熱劑可用于焊接鋼軌。現取不同質量的該鋁熱劑分別和100mL同濃度的NaOH溶液反應,所取鋁熱劑的質量與產生氣體的體積關系如表(氣體體積均在標準狀況下測定)。
① | ② | ③ | |
鋁熱劑質量/g | 7.5 | 15.0 | 20.0 |
氣體體積/L | 3.36 | 6.72 | 6.72 |
計算:
(1)NaOH溶液物質的量濃度_______
(2)該鋁熱劑中鋁的質量分數_______
(3)15g該鋁熱劑發生鋁熱反應理論上產生鐵的質量。_______
查看答案和解析>>
科目: 來源: 題型:
【題目】在一體積可變的密閉容器中,加入一定量的X,Y,Z,發生反應mX(g)+nY(g) pZ(g) ΔH=QkJ·mol-1。反應達到平衡后,Y的物質的量濃度與溫度、容器體積的關系如下表所示。下列說法不正確的是

A.![]() B.體積不變,溫度升高,平衡向逆反應方向移動
B.體積不變,溫度升高,平衡向逆反應方向移動
C.Q<0D.溫度不變,壓強增大,Y的質量分數增大
查看答案和解析>>
科目: 來源: 題型:
【題目】NaClO廣泛用作消殺劑、水處理劑及漂白劑等。
已知:NaClO溶液中物種分布分數與溶液pH的關系如圖1所示。
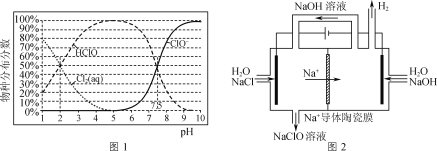
(1)向NaClO溶液中通入CO2,發生反應的離子方程式為___(H2CO3的lgKa1、lgKa2依次為-6.38、-10.21);反應ClO-+H2O![]() HClO+OH-的lgK=____。
HClO+OH-的lgK=____。
(2)用Na+導體陶瓷膜電解法生產次氯酸鈉溶液的裝置如圖2所示。
①陽極產生Cl2的電極反應式為____。
②其他條件不變,若撤去“Na+導體陶瓷膜”,NaClO的產率則會降低,其主要原因是___。
(3)NaClO溶液中ClO-與H2O產生更強氧化性的HClO,可將水體中氨氮氧化為N2(NH3比NH![]() 更易被氧化)。室溫時,取氨氮廢水200mL,在轉速、NaClO投加量相同且均反應30min時,反應初始pH對剩余氨氮濃度及氨氮去除率的影響如圖3所示。
更易被氧化)。室溫時,取氨氮廢水200mL,在轉速、NaClO投加量相同且均反應30min時,反應初始pH對剩余氨氮濃度及氨氮去除率的影響如圖3所示。
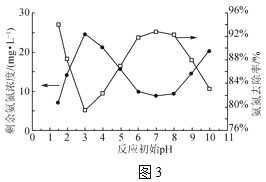
①NaClO氧化NH3的化學方程式為___。
②pH在3~7時,隨pH增大氨氮去除率升高的原因是___。
③pH在7~9時,隨pH增大氨氮去除率降低的原因是__。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com