
科目: 來源: 題型:
【題目】甲烷水蒸氣重整制取的合成氣可用于熔融碳酸鹽燃料電池。
(1)制取合成氣的反應為CH4(g)+H2O(g)![]() CO(g)+3H2(g)H =+206 kJ/mol。
CO(g)+3H2(g)H =+206 kJ/mol。
向體積為2 L密閉容器中,按n(H2O)∶n(CH4)=1投料:
a.保持溫度為T1時,測得CH4(g)的濃度隨時間變化曲線如圖1所示。
b.其他條件相同時,在不同催化劑(Ⅰ、Ⅱ、Ⅲ)作用下,反應相同時間后,CH4的轉化率隨反應溫度的變化如圖2所示。

①結合圖1,寫出反應達平衡的過程中的能量變化:______kJ。
②在圖1中畫出:起始條件相同,保持溫度為T2(T2> T1)時, c(CH4)隨時間的變化曲線______。
③根據圖2判斷:
ⅰ. a點所處的狀態不是化學平衡狀態,理由是_______。
ⅱ. CH4的轉化率:c>b,原因是________。
(2)熔融碳酸鹽燃料電池的結構示意圖如下。

①電池工作時,熔融碳酸鹽中CO32-移向________(填“電極A”或“電極B”)
②寫出正極上的電極反應:________。
(3)若不考慮副反應,1 kg甲烷完全轉化所得到的合成氣全部用于燃料電池中,外電路通過的電子的物質的量最大為_____mol。
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗小組利用傳感器探究Na2CO3和NaHCO3的性質。
實驗操作 | 實驗數據 |
測量下述實驗過程的pH變化
|
|
下列分析不正確的是
A.①與②的實驗數據基本相同,說明②中的OH-未參與該反應
B.加入試劑體積相同時,②所得沉淀質量大于③所得沉淀質量
C.從起始到a點過程中反應的離子方程式為:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
D.b點對應溶液中水的電離程度小于c點對應溶液中水的電離程度
查看答案和解析>>
科目: 來源: 題型:
【題目】將32.64 g銅與140 mL一定濃度的硝酸反應,銅完全溶解,產生的NO和NO2混合氣體在標準狀況下的體積為11.2 L。請回答下列問題:
(1)NO的體積為________L,NO2的體積為________L。
(2)參加反應的HNO3的物質的量是________。
(3)待產生的氣體全部釋放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部轉化成沉淀,則原硝酸溶液的濃度為________mol·L-1。
(4)欲使銅與硝酸反應生成的氣體在NaOH溶液中全部轉化為NaNO3,至少需要30%的雙氧水________g。
(5)欲使銅與硝酸反應生成的氣體在NaOH溶液中全部轉化為NaNO3,至少需要通O2______mol。
查看答案和解析>>
科目: 來源: 題型:
【題目】二氧化硫是重要的工業原料,探究其制備方法和性質具有非常重要的意義。
(1)簡述使用分液漏斗向圓底燒瓶中滴加濃硫酸的操作____。
(2)某學習小組設計用如下圖裝置驗證二氧化硫的化學性質。


(3)能說明SO2具有氧化性的實驗現象為_________________。
(4)為驗證SO2的還原性,充分反應后,取試管b中溶液分成三份,分別進行如下實驗:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品紅溶液,紅色退去
方案Ⅲ:向第三份溶液加入BaCl2溶液,產生白色沉淀
上述方案中合理的是________(填“Ⅰ”“Ⅱ”或“Ⅲ”);試管b中發生反應的離子方程式為__________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】有關甲、乙、丙、丁四個圖示的敘述正確的是( )
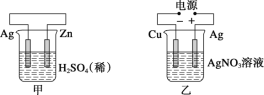
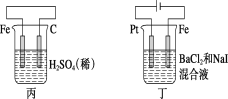
A.甲中負極反應式為2H++2e-=H2↑
B.乙中陽極反應式為Ag++e-=Ag
C.丙中H+向碳棒方向移動
D.丁中電解開始時陽極產生黃綠色氣體
查看答案和解析>>
科目: 來源: 題型:
【題目】噴泉實驗是中學化學的重要實驗。
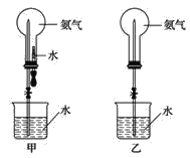
(1)實驗室中常用圖甲裝置進行NH3的噴泉實驗。用該裝置完成噴泉實驗的操作方法是_________。
(2)若用圖乙裝置進行NH3的噴泉實驗,打開止水夾后,燒杯中的液體不能進入燒瓶。請寫出引發噴泉實驗的一種操作方法:____________。
(3)若將圖甲裝置中膠頭滴管和燒杯中液體改為NaOH溶液,能用改動后的甲裝置進行噴泉實驗的一組氣體是_________(填字母)。
A.HCl和CO2 B.Cl2和CO C.O2和SO2 D.NO2和NO
查看答案和解析>>
科目: 來源: 題型:
【題目】如下圖,a、b是石墨電極,通電一段時間后,b極附近溶液顯紅色。下列說法正確的是

A. Pt為陰極,Cu為陽極
B. b極的電極反應式是2H++2e-=H2↑
C. 電解過程中CuSO4溶液的pH逐漸增大
D. Pt極上有6.4 g Cu析出時,b極產生2.24 L(標準狀況)氣體
查看答案和解析>>
科目: 來源: 題型:
【題目】已知:Br2常溫下呈液態、易揮發、有毒。如圖為實驗室模擬工業過程從濃縮的海水中提取溴的實驗裝置。
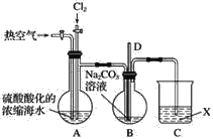
其實驗步驟如下:
Ⅰ.在燒瓶中加入硫酸酸化的濃縮海水,持續通入Cl2一段時間,溶液變為淺棕色后,停止通入Cl2,改通入熱空氣;
Ⅱ.當A與B燒瓶溶液均變為無色的時候,停止通入熱空氣;
Ⅲ.將燒瓶B中的溶液倒入分液漏斗,加入稀硫酸酸化后,用CC14萃取,再經過蒸餾分離提取出其中的溴。
請回答:
(1)燒瓶A中通入Cl2過程中發生反應的離子方程式為_______________________。
(2)步驟Ⅰ中通入熱空氣的目的是_______________________。
(3)裝置B中導管D的作用是____________________,裝置C中的溶液X為____________。
(4)步驟Ⅲ中加入稀硫酸酸化發生的反應為5Br-+BrO3-+6H+===3Br2+3H2O,每生成1 mol Br2單質,轉移的電子數為________mol。
查看答案和解析>>
科目: 來源: 題型:
【題目】800℃時,三個相同的恒容密閉容器中發生反應CO(g) + H2O(g)![]() CO2(g) + H2(g) K,一段時間后,分別達到化學平衡狀態。
CO2(g) + H2(g) K,一段時間后,分別達到化學平衡狀態。
容器編號 | 起始濃度/(mol·L1) | |||
c(CO) | c(H2O) | c(CO2) | c(H2) | |
Ⅰ | 0.01 | 0.01 | 0 | 0 |
Ⅱ | 0 | 0 | 0.01 | 0.01 |
III | 0.008 | 0.008 | 0.002 | 0.002 |
下列說法不正確的是
A.Ⅱ 中達平衡時,c(H2)=0.005 mol·L1
B.III中達平衡時,CO的體積分數大于25%
C.III中達到平衡狀態所需的時間比 Ⅰ 中的短
D.若III中起始濃度均增加一倍,平衡時c(H2)亦增加一倍
查看答案和解析>>
科目: 來源: 題型:
【題目】將固體NH4I置于密閉容器中,在一定溫度下發生下列反應:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) ![]() H2(g)+I2(g)達到平衡時,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,則此溫度下反應①的平衡常數為( )
H2(g)+I2(g)達到平衡時,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,則此溫度下反應①的平衡常數為( )
A. 36 B. 24 C. 16 D. 9
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com