
科目: 來源: 題型:
【題目】下列有關苯甲酸苯甲酯( )的說法正確的是( )
)的說法正確的是( )
A.能發生取代反應和加成反應B.所有的碳原子不可能共平面
C.1mol該物質完全燃燒需要17molO2D.其一氯代物有4種
查看答案和解析>>
科目: 來源: 題型:
【題目】為檢驗淀粉水解的情況,進行如圖所示的實驗,試管甲和丙均用60~80℃的水浴加熱5~6min,試管乙不加熱。
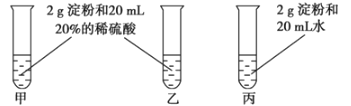
待試管甲中的溶液冷卻后再進行后續實驗。
實驗①:取少量甲中溶液,加入新制氫氧化銅,加熱,沒有磚紅色沉淀出現。
實驗②:取少量乙中溶液,滴加幾滴碘水,溶液變為藍色,但取少量甲中溶液做此實驗時,溶液不變藍色。
實驗③:取少量丙中溶液加入氫氧化鈉溶液調節至堿性,再滴加碘水,溶液顏色無明顯變化。
(1)寫出淀粉水解的化學方程式_____________________。
(2)設計甲和乙是為了探究________對淀粉水解的影響,設計甲和丙是為了探究________對淀粉水解的影響。
(3)實驗①失敗的原因是_____________________________。
(4)實驗③中溶液的顏色無明顯變化的原因是______________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】三氧化二砷(As2O3)可用于治療急性早幼粒白血病。利用某酸性含砷廢水(含![]() 、H+、
、H+、![]() )可提取三氧化二砷,提取工藝流程如下:
)可提取三氧化二砷,提取工藝流程如下:
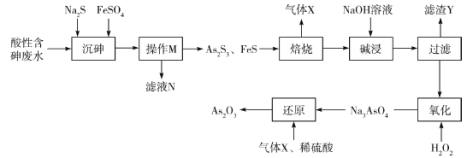
已知:①常溫下,![]() ;
;![]() 。
。
②As2O3+6NaOH=2Na3AsO3+3H2O。
③As2S3易溶于過量的Na2S溶液中,故加入FeSO4的目的是除去過量的S2-。
回答下列問題:
(1)操作M的名稱是________,濾液N中含有的陽離子有Fe2+、H+、________。
(2)“焙燒”操作中,As2S3參與反應的化學方程式為____________。
(3)“堿浸”的目的是_____________,“濾渣Y”的主要成分是_____________(寫化學式)。
(4)“氧化”中發生反應的離子方程式為___________________。
(5)該流程中可循環使用的物質是_________(寫化學式),某次“還原”過程中制得了1.98kgAs2O3,則消耗標準狀況下該物質的體積是________L。
(6)溶液中金屬離子的除去方法之一是Na2S沉降法。常溫下,若某溶液中含Fe2+、Ag+,且濃度均為0.1mol·L-1,則向該溶液中滴加稀Na2S溶液時,先生成的沉淀是________(填化學式)。
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗小組用下列裝置進行乙醇催化氧化的實驗。已知:乙醛可被氧化為乙酸。
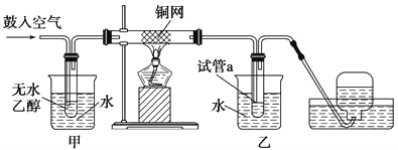
(1)實驗過程中銅網出現紅色和黑色交替的現象,請寫出相應的化學方程式__________________ 、_____________________。
(2)在不斷鼓入空氣的情況下,熄滅酒精燈,反應仍能繼續進行,說明該乙醇催化反應是____________ 反應。進一步研究表明,鼓入空氣的速率與反應體系的溫度關系曲線如圖所示。
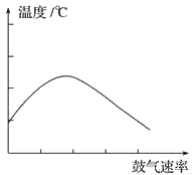
試解釋出現圖中現象的原因_______________________。
(3)甲和乙兩個水浴作用不相同。甲的作用是_______________;乙的作用是______________。
(4)若試管a中收集到的液體用紫色石蕊試紙檢驗,試紙顯紅色,說明液體中還含有_______。要除去該物質,可在混合液中加入________ (填寫字母)。然后,再通過________________(填實驗操作名稱)即可除去。
A.氯化鈉溶液 B.苯 C.碳酸氫鈉溶液 D.四氯化碳
查看答案和解析>>
科目: 來源: 題型:
【題目】利用煤化工所得的苯可合成甲苯、乙苯、環己烷,其反應如下:
①![]() +CH3Cl
+CH3Cl![]() (甲苯)+HCl
(甲苯)+HCl
②CH2===CH2+![]()
![]() (乙苯)
(乙苯)
③![]() +3H2
+3H2![]()
下列說法正確的是( )
A.反應①、②、③均屬于加成反應
B.溴水中加入苯,二者可發生取代反應
C.乙苯中所有碳原子一定在同一平面上
D.能用溴水判斷反應②所得的乙苯中是否混有乙烯
查看答案和解析>>
科目: 來源: 題型:
【題目】正常人心臟在一次搏動中泵出血液約80 mL,正常人血壓(可看作心臟壓送血液的壓強)平均值為1.6×104Pa,心跳每分鐘約70次。設人類消耗體內的葡萄糖產生的熱量最高可有80%(睡眠時)用來維持心臟的跳動,葡萄糖與氧氣反應產生熱量的化學方程式為:C6H12O6(s)+6O2(g)―→6CO2(g)+6H2O(g)(放出熱量2804 kJ)
(1)心臟工作的平均功率約為______________;
(2)由于心臟跳動每天需消耗葡萄糖的質量是____________________________;
(3)維持生命每天需消耗氧氣的體積是___________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列三個化學反應的平衡常數(K1、K2、K3)與溫度的關系分別如表所示:
化學反應 | 平衡常數 | 溫度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
下列說法正確的是
A.ΔH1<0,ΔH2>0
B.反應①②③的反應熱滿足關系:ΔH1-ΔH2=ΔH3
C.反應①②③的平衡常數滿足關系:K1·K2=K3
D.要使反應③在一定條件下建立的平衡向正反應方向移動,可采取降溫措施
查看答案和解析>>
科目: 來源: 題型:
【題目】在密閉容器中發生下列反應aA(g)![]() cC(g)+dD(g),反應達到平衡后,將氣體體積壓縮到原來的一半,當再次達到平衡時,D的濃度為原平衡1.8倍,下列敘述正確的是
cC(g)+dD(g),反應達到平衡后,將氣體體積壓縮到原來的一半,當再次達到平衡時,D的濃度為原平衡1.8倍,下列敘述正確的是
A.平衡向正反應方向移動B.A的轉化率變大
C.D的物質的量變多D.a<c+d
查看答案和解析>>
科目: 來源: 題型:
【題目】下列對化學平衡移動的分析中,正確的是
A.平衡的反應C(s)+H2O(g)![]() CO(g)+H2(g),當增加反應物的物質的量時,平衡一定向正反應方向移動
CO(g)+H2(g),當增加反應物的物質的量時,平衡一定向正反應方向移動
B.已達平衡的反應N2(g)+3H2(g)![]() 2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率降低
2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率降低
C.有氣體參加的反應達到平衡時,若減小反應器容積時,平衡一定向氣體體積增大的方向移動
D.有氣體參加的反應達到平衡時,在恒壓反應器中充入稀有氣體,平衡一定不移動
查看答案和解析>>
科目: 來源: 題型:
【題目】亞硝酰硫酸(NOSO4H)純品為棱形結晶,溶于硫酸,遇水易分解,常用于制染料。制備NOSO4H的反應原理為:![]() 、
、![]() 。
。
(1)亞硝酰硫酸(NOSO4H)的制備。
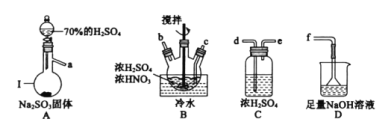
①儀器Ⅰ的名稱為_________。
②按氣流從左到右的順序,上述儀器的連接順序為____(填儀器接口字母,部分儀器可重復使用)。
③為了控制B中通入SO2的速率,可以采取的措施是_____。
④NOSO4H遇水分解的化學方程式為______,若去掉裝置C會使NOSO4H的產量____(填“增大”、“減少”或“無影響”)。
(2)亞硝酰硫酸(NOSO4H)純度的測定。
準確稱取1.337g產品加入250mL碘量瓶中,加入60.00mL濃度為0.1000mol·L-1KMnO4標準溶液和10mL25%H2SO4溶液,然后搖勻。用0.2500mol·L-1Na2C2O4標準溶液滴定,消耗Na2C2O4溶液的體積20.00mL。
己知:ⅰ. ![]() + NOSO4H+
+ NOSO4H+ ![]() 、 +
、 + ![]() +
+ ![]() +
+ ![]()
ⅱ.![]()
①完成反應ⅰ的離子方程式:
____![]() +____
+____![]() ____
____![]() ____+____
____+____![]() +____
+____![]() +____
+____![]()
②滴定終點的現象為________。
③產品的純度為_____%(保留兩位有效數字)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com