
科目: 來源: 題型:
【題目】由合成氣制備二甲醚的主要原理如下。下列有關說法正確的是
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.7 kJ·mol-1
CH3OH(g) ΔH1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1
A.將1mol CO(g)和2 mol H2(g)充分反應,反應會放出90.7 kJ能量
B.反應①的ΔS>0
C.反應③使用催化劑,ΔH3減少
D.反應3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的ΔH=-246.1 kJ·mol-1
CH3OCH3(g)+CO2(g)的ΔH=-246.1 kJ·mol-1
查看答案和解析>>
科目: 來源: 題型:
【題目】下表是元素周期表的一部分,表中所列的字母分別代表某一化學元素。
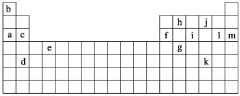
下列______(填寫編號)組元素的單質可能都是電的良導體。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
查看答案和解析>>
科目: 來源: 題型:
【題目】短周期主族元素![]() 、
、![]() 、
、![]() 、
、![]() 原子序數(shù)依次增大,
原子序數(shù)依次增大,![]() 與
與![]() 同主族但最高化合價不同,
同主族但最高化合價不同,![]() 是金屬性最強的短周期元素。下列說法不正確的是( )。
是金屬性最強的短周期元素。下列說法不正確的是( )。
A.簡單離子半徑:![]()
B.最高價氧化物對應水化物的酸性:![]()
C.化合物![]() 能與水劇烈反應,產生白霧并放出具有刺激性氣味的氣體
能與水劇烈反應,產生白霧并放出具有刺激性氣味的氣體
D.![]() 的氣態(tài)氫化物通入
的氣態(tài)氫化物通入![]() 水溶液中產生淡黃色沉淀并放出有刺激性氣味的氣體
水溶液中產生淡黃色沉淀并放出有刺激性氣味的氣體
查看答案和解析>>
科目: 來源: 題型:
【題目】硫酸鉛是一種重要的化工粉末材料,被廣泛用于涂料和電池等行業(yè)。濕化學法從方鉛礦(主要成分為![]() )直接制取硫酸鉛粉末的轉化流程圖如下:
)直接制取硫酸鉛粉末的轉化流程圖如下:
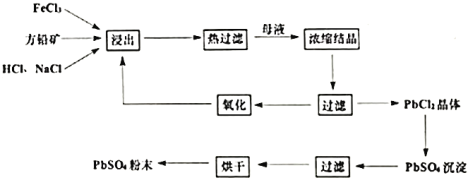
已知:①![]()
②![]()
![]()
回答下列問題:
(1)浸出過程中,產物中![]() 以
以![]() 形式存在,同時可觀察到黃色沉淀,浸出過程中的反應的離子方程式為________________。反應后期,有少量氣體產生,產生氣體的化學方程式為________________。
形式存在,同時可觀察到黃色沉淀,浸出過程中的反應的離子方程式為________________。反應后期,有少量氣體產生,產生氣體的化學方程式為________________。
(2)濃縮結晶過程中是將浸出液靜置于冰水混合物中,從平衡角度解釋使用冰水混合物的作用為________。
(3)氧化過程中通常加入![]() ,發(fā)生反應的離子方程式為__________。
,發(fā)生反應的離子方程式為__________。
(4)向![]() 固體中加入
固體中加入![]() ,發(fā)生反應的方程式為
,發(fā)生反應的方程式為![]()
![]() ,計算該反應的平衡常數(shù)為________。
,計算該反應的平衡常數(shù)為________。
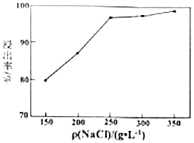
(5)單位體積溶液中加入![]() 的質量對方鉛礦的浸出率的影響如圖,高于
的質量對方鉛礦的浸出率的影響如圖,高于![]() 之后,浸出率基本不變,可能的原因是_____________。
之后,浸出率基本不變,可能的原因是_____________。
(6)傳統(tǒng)工藝是經火法冶煉得到粗鉛,然后電解精煉,再經高溫熔融、氧化焙燒制取氧化鉛,然后與硫酸反應制得硫酸鉛。與傳統(tǒng)工藝相比,濕化學法的優(yōu)點是________(任寫兩點)。
查看答案和解析>>
科目: 來源: 題型:
【題目】現(xiàn)有部分短周期元素的原子結構如下表:
元素編號 | 元素原子結構 |
X | 原子結構示意圖為 |
Y | 最外層電子數(shù)是次外層電子數(shù)的2倍 |
Z | 原子核內含有12個中子,且其離子的結構示意圖為 |
(1)寫出X的元素符號:____________,元素Y的最簡單氫化物的化學式為______________。
(2)Z元素原子的相對原子質量為____________。
(3)X和Z兩種元素的最高價氧化物對應的水化物相互反應的離子方程式為______________。
(4)Y和Z兩種元素的最高價氧化物發(fā)生氧化還原反應的化學方程式為__________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】有四種短周期元素A、B、C、D,它們的核電荷數(shù)依次增大。A與C,B與D分別是同主族元素。B、D質子數(shù)之和是A、C質子數(shù)之和的2倍。這四種元素中A、C、D的單質均可在B的單質中燃燒。
(1)A的元素名稱是________,C的元素符號是________。
(2)D元素位于元素周期表的第______周期第______族。
(3)C元素的單質在B的單質中燃燒的產物的化學式是________。
查看答案和解析>>
科目: 來源: 題型:
【題目】堿式硫酸鐵[Fex(OH)y(SO4)z](其中Fe元素為+ 3價)是一種新型高效絮凝劑。一種利用廢鐵屑(含Fe和少量Al2O3、Fe2O3)生產堿式硫酸鐵的工藝流程如下:
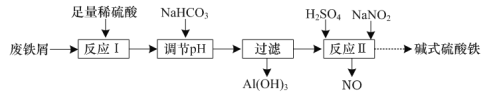
下列說法正確的是
A.x、y、z一定符合關系式:x=y=z
B.“過濾”所得濾液中只含溶質FeSO4
C.“反應Ⅰ”中包含的反應類型有置換反應、化合反應和復分解反應
D.在實際生產中,反應Ⅱ常同時通入O2以減少NaNO2的用量,若有11.2 L(標準狀況)的O2參與反應,則相當于節(jié)約2 mol NaNO2
查看答案和解析>>
科目: 來源: 題型:
【題目】圖是某甲醇燃料電池的工作示意圖。下列說法正確的是

A.電極b為電池的負極
B.電池工作時將電能轉化為化學能
C.放電時a極處所發(fā)生的電極反應為:CH3OH-6e-+H2O=CO2↑+6H+
D.放電時溶液中H+向a極移動
查看答案和解析>>
科目: 來源: 題型:
【題目】有A、B、C、D四種元素,A元素的原子得2個電子、B元素的原子失去1個電子后所形成的微粒均與氬原子有相同的核外電子數(shù)。C元素的原子只有1個電子,A、D兩元素原子核外電子總數(shù)比B元素原子質子數(shù)多9個。
(1)A的元素名稱是_______,B的元素符號是______。
(2)D原子的原子結構示意圖為____________,B+的離子結構示意圖__________。
查看答案和解析>>
科目: 來源: 題型:
【題目】工業(yè)上用重鉻酸鈉(Na2Cr2O7)結晶后的母液(含少量雜質Fe3+)生產重鉻酸鉀(K2Cr2O7)。工藝流程如下:

⑴Na2Cr2O7可由FeO·Cr2O3先氧化、再酸化得到。其中FeO·Cr2O3發(fā)生氧化反應的化學方程式為4FeO·Cr2O3+7O2+20NaOH![]() 8Na2CrO4+4NaFeO2+10H2O。該反應中每生成1 mol NaFeO2,被Fe元素還原的O2的物質的量為______mol。
8Na2CrO4+4NaFeO2+10H2O。該反應中每生成1 mol NaFeO2,被Fe元素還原的O2的物質的量為______mol。
⑵“調節(jié)pH=4”后,溶液中c(Fe3+)=4×10-8 mol·L-1,則該溫度下Ksp[Fe(OH)3]=______。
⑶已知部分物質的溶解度曲線如圖所示。反應Ⅰ的化學反應類型為______。實驗室由質量分數(shù)為10%的K2Cr2O7溶液獲取K2Cr2O7晶體的方法是______。
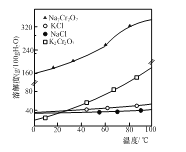
⑷為測定K2Cr2O7樣品純度(雜質不參與反應),實驗過程為:準確稱量一定質量樣品,與足量酸性KI 溶液充分反應后,用Na2S2O3標準溶液滴定生成的I2。實驗過程中發(fā)生的物質轉化關系分別為:Cr2O72-![]() Cr3+ S2O32-
Cr3+ S2O32-![]() S4O62-,根據(jù)電子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=______。
S4O62-,根據(jù)電子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=______。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com