
科目: 來源: 題型:
【題目】根據下圖所示實驗,回答問題:
(1)實驗①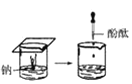 觀察到的現象是________________________。實驗②
觀察到的現象是________________________。實驗②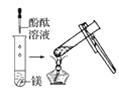 觀察到的現象是________________________。
觀察到的現象是________________________。
(2)實驗③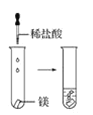 觀察到的現象是________________________。實驗④
觀察到的現象是________________________。實驗④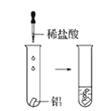 觀察到的現象是________________________。
觀察到的現象是________________________。
(3)由上述實驗,你能得出的結論是________________________。
(4)請總結同周期元素金屬性的變化規律__________,并用原子結構解釋其原因_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某同學想通過實驗探究硫和碳得電子能力的強弱,通過比較它們最高價氧化物對應水化物的酸性強弱來驗證,設計了如圖實驗。

(1)儀器a的名稱是________,應盛放下列藥品中的________(填字母)。
A.稀硫酸 B.亞硫酸C.氫硫酸 D.鹽酸
(2)儀器b的名稱是________,應盛放下列藥品中的________(填字母)。
A.碳酸鈣 B.硫酸鈉 C.氯化鈉 D.碳酸鈉
(3)儀器c中應盛放的試劑是________,如果看到的現象是____________________,證明b中反應產生了________,即可證明________比________酸性強,得電子能力________比________強,b中發生反應的離子方程式為______________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】現有①氯化鋇、②金剛石、③氯化銨、④硫酸鈉、⑤干冰、⑥碘片六種物質,按下列要求回答:
(1)熔化時不需要破壞化學鍵的是________,熔化時需要破壞共價鍵的是________,熔點最高的是________,熔點最低的是________。
(2)屬于離子化合物的是________,只有離子鍵的物質是________,以分子間作用力結合的是________。
(3)①的電子式是____________,⑥的電子式是____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】將氣體A、B置于固定容積為2 L的密閉容器中,發生如下反應:3A(g)+B(g)2C(g)+2D(g),反應進行到10 s末,達到平衡,測得A的物質的量為1.8 mol,B的物質的量為0.6 mol,C的物質的量為0.8 mol。
(1)用C表示10 s內反應的平均反應速率為________。
(2)反應前A的物質的量濃度是________。
(3)10 s末,生成物D的濃度為________。
(4)A與B的平衡轉化率之比為________。
(5)反應過程中容器內氣體的平均相對分子質量變化是________(填“增大”、“減小”或“不變”,下同),氣體的密度變化是________。
(6)平衡后,若改變下列條件,生成D的速率如何變化(填“增大”、“減小”或“不變”):①降低溫度______;②增大A的濃度________;③恒容下充入氖氣_______。
查看答案和解析>>
科目: 來源: 題型:
【題目】氯化鐵和摩爾鹽是鐵的兩種重要鹽類,在凈水和定量分析等方面具有重要作用。
(1) 用FeCl3溶液腐蝕印刷電路板上的銅,向所得溶液中加入鐵粉,對加入鐵粉充分反應后的溶液分析合理的是____________。
a. 若無固體剩余,則溶液中一定有Fe3+ b. 若有固體存在,則溶液中一定有Fe2+
c. 若溶液中有Cu2+,則一定沒有固體析出 d. 若溶液中有Fe2+,則一定有Cu析出
(2)工業上通過氧化酸性FeCl2廢液得到含FeCl3的溶液。若酸性FeCl2廢液中 ![]() ,
,![]() ,
,![]() ,則該溶液的
,則該溶液的![]() 約為______(不考慮水的電離和離子的水解)。
約為______(不考慮水的電離和離子的水解)。
(3)摩爾鹽 [(NH4)2Fe(SO4)26H2O]在定量分析中常作為基準物質,用來標定重鉻酸鉀、高錳酸鉀等溶液的濃度,在![]() 的該鹽的溶液中,離子濃度由大到小的順序是____________。
的該鹽的溶液中,離子濃度由大到小的順序是____________。
(4)摩爾鹽與酸性高錳酸鉀發生反應:![]()
a.配平上述離子方程式:(___________)Fe2++(____________)MnO4-+(___________)H+→(_________)Mn2++(__________)Fe3++(___________)H2O
b.已知摩爾鹽相對分子質量為![]() ,取摩爾鹽產品
,取摩爾鹽產品![]() (雜質不與高錳酸鉀反應),配成
(雜質不與高錳酸鉀反應),配成![]() 溶液,取出
溶液,取出![]() 用
用![]() 溶液滴定,消耗
溶液滴定,消耗![]() 溶液
溶液![]() ,則產品中摩爾鹽的質量分數為____________(用小數表示,保留四位小數)。
,則產品中摩爾鹽的質量分數為____________(用小數表示,保留四位小數)。
查看答案和解析>>
科目: 來源: 題型:
【題目】將4 mol A氣體和2 mol B氣體在2 L的容器中混合并在一定條件下發生如下反應:2A(g)+B(g)2C(g)。若經2 s時測得C的濃度為0.6 mol·L-1,填寫下列空白:
(1)用物質A表示反應的平均速率為_________。
(2)用物質B表示反應的平均速率為_________。
(3)2 s時物質A的轉化率為_________。
(4)2 s時物質B的體積分數為_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)在反應A(g)+3B(g)=2C(g)中,若以物質A表示的該反應的化學反應速率為0.2 mol·L1·min1,則以物質B表示此反應的化學反應速率為________mol·L1·min1。
(2)在2 L的密閉容器中,充入2 mol N2和3 mol H2,在一定條件下發生反應,3 s后測得N2為1.9 mol,則以H2的濃度變化表示的反應速率為____________________________。
(3)將10 mol A和5 mol B放入容積為10 L的密閉容器中,某溫度下發生反應:3A(g)+B(g) ![]() 2C(g),在最初2 s內,消耗A的平均速率為0.06 mol·L1·s1,則在2 s時,容器中有______ mol A,此時C的物質的量濃度為________。
2C(g),在最初2 s內,消耗A的平均速率為0.06 mol·L1·s1,則在2 s時,容器中有______ mol A,此時C的物質的量濃度為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】堿金屬元素按原子序數增大,依次為:鋰(![]() )、鈉(
)、鈉(![]() )、鉀(
)、鉀(![]() )、銣(
)、銣(![]() )、銫(
)、銫(![]() )、鈁(
)、鈁(![]() ,放射性元素)。請回答:
,放射性元素)。請回答:
(1) 鈉鉀合金許多特殊反應中有著非常重要的應用。取![]() 鈉鉀合金和一定量四氯化碳在一定條件下恰好完全反應,制造出
鈉鉀合金和一定量四氯化碳在一定條件下恰好完全反應,制造出![]() 納米級金剛石粉末。則該鈉鉀合金中鈉元素和鉀元素的質量比為______。
納米級金剛石粉末。則該鈉鉀合金中鈉元素和鉀元素的質量比為______。
(2)將一定量的鋁和過氧化鈉混合物投入一盛有![]() 蒸餾水的燒杯中,反應終止時得到一澄清溶液,所得溶液的質量比反應前上述三種物質總質量之和減少
蒸餾水的燒杯中,反應終止時得到一澄清溶液,所得溶液的質量比反應前上述三種物質總質量之和減少![]() ,再向所得溶液中滴加
,再向所得溶液中滴加![]() 鹽酸直至產生的沉淀剛好溶解,消耗鹽酸
鹽酸直至產生的沉淀剛好溶解,消耗鹽酸![]() 。求原混合物中
。求原混合物中![]() 和
和![]() 各多少克?____、____
各多少克?____、____
(3)一定條件下,![]() 銣與氧氣和臭氧的混合氣體
銣與氧氣和臭氧的混合氣體![]() (已折算為標況,且該混合氣體對相同狀況下氫氣的相對密度為20.8)恰好完全反應,得到兩種離子化合物
(已折算為標況,且該混合氣體對相同狀況下氫氣的相對密度為20.8)恰好完全反應,得到兩種離子化合物![]() 和
和![]() 的固體混合物。
的固體混合物。![]() 和
和![]() 中,陰陽離子個數比均為
中,陰陽離子個數比均為![]() 且均在兩種微粒間作用力。已知
且均在兩種微粒間作用力。已知![]() 的含氧量為0.3596。推斷化合物
的含氧量為0.3596。推斷化合物![]() 、
、![]() 的化學式分別為:____________、____________。
的化學式分別為:____________、____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】谷物中脂肪含量雖少,但卻是其品質優劣的指標之一。黃玉米中粗脂肪(以亞油酸甘油酯為主)含量測定的實驗流程如下:
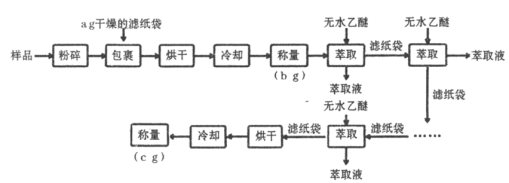
已知:亞油酸甘油酯沸點![]() ;乙醚熔點
;乙醚熔點![]() ,沸點
,沸點![]() ,易燃。
,易燃。
回答下列問題:
(1)實驗中兩次“冷卻”均在干燥器中進行,其目的是____________________。
(2)上述實驗中多次“萃取”均在下列____________儀器中進行(填字母標號)。
|
|
|
a | b | c |
(3)為了克服多次萃取實驗操作繁瑣,萃取劑消耗量過大的缺點, Franz von Soxhlet發明了索氏抽提筒。若將上述實驗的多次萃取改為在下圖裝置中進行(約需10~12h):
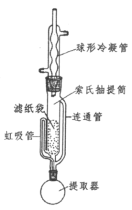
①為提高乙醚蒸氣的冷凝效果,球形冷凝管可改用_____________(填儀器名稱)。實驗中常在冷凝管上口連接一個裝有活性炭的球形干燥管,其目的是_______________。
②實驗中需控制提取器(燒瓶)溫度在60℃~70℃之間,應采取的加熱方式是_____________________。
③索氏提取法原理:當無水乙醚加熱沸騰后,蒸氣通過____________(填字母標號,下同)上升,被冷凝為液體滴入抽提筒中,當液面超過________________________最高處時,萃取液即回流入提取器(燒瓶)中……如此往復。
a.冷凝管 b.虹吸管 c.連通管
④索氏提取法存在的明顯缺點是__________________。
(4)數據處理:樣品中純脂肪百分含量_______________(填“<”、“>”或“=”)![]() ,原因是_______________________。
,原因是_______________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】按照下圖所示的操作步驟,完成氫氧化鈉與鹽酸的反應的實驗。

回答下列問題:
(1)反應后混合溶液的溫度與反應前鹽酸和氫氧化鈉溶液的溫度相比較其變化是___________________________________。
(2)你認為酸堿中和反應是放熱反應還是吸熱反應____________________________________。
(3)寫出該反應的離子方程式:____________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com