
科目: 來源: 題型:
【題目】2019年諾貝爾化學獎已授予約翰·班寧斯特·古迪納夫、斯坦利·惠廷漢姆和吉野彰,三位科學家的獲獎理由是為鋰電池的發展做出了卓越貢獻。下圖是我國一項電解制備金屬鋰的新方法發明專利裝置圖。下列說法不正確的是
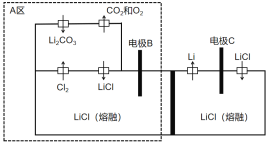
A.電極B的電勢比電極C高
B.理論上該裝置不需要補充電解質LiCl
C.電極B中氯離子和碳酸根離子放電
D.A區避免熔融碳酸鋰對設備的腐蝕且減少了環境污染
查看答案和解析>>
科目: 來源: 題型:
【題目】外循環三相反應器連續制備高錳酸鉀新技術是目前高錳酸鉀工業發展的主要方向。該法以軟錳礦(主要成分為MnO2)為原料生產高錳酸鉀。該工藝路線制備高錳酸鉀如下:

![]()
已知:一些化合物溶解度(單位:g)隨溫度的變化如表
溫度℃ | KMnO4 | KCl | K2CO3 |
20 | 6.4 | 34.0 | 52.5 |
90 | 45.2 | 56.7 | 60.9 |
回答下列問題:
(1)原料軟錳礦與氫氧化鉀按一定的比例在“進料”時加熱熔融后再和氧氣進行“反應”,“進料”前應將軟錳礦粉碎,其作用是____。
(2)“反應”中發生反應的化學方程式為____。
(3)將K2MnO4轉化為KMnO4的生產有兩種工藝。
①“CO2歧化法”是傳統工藝,即向溶液中通入CO2氣體,使體系呈中性或弱堿性。
K2MnO4發生歧化反應時,能否用鹽酸代替CO2____(請填寫“能”或“不能”)。待錳酸鉀全部歧化后,靜置一段時間后過濾。從濾液中得到高錳酸鉀晶體的操作是:____。
②“電解法”為現代工藝,即電解K2MnO4水溶液,電解槽中陽極發生的電極反應為____,電解產物____可以循環利用。
③“CO2歧化法”和“電解法”相比較,K2MnO4的理論利用率之比為____。
查看答案和解析>>
科目: 來源: 題型:
【題目】為了避免NO、NO2、N2O4對大氣的污染,常采用NaOH溶液進行吸收處理(反應方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。現有由a mol NO、b mol NO2、c mol N2O4組成的混合氣體恰好被V L NaOH溶液吸收(無氣體剩余),則此NaOH溶液的物質的量濃度為( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目: 來源: 題型:
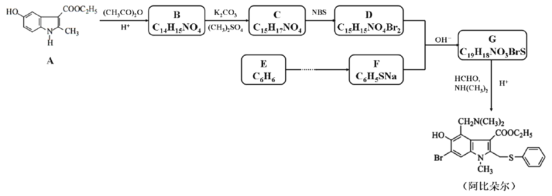
【題目】藥物阿比朵爾具有很好的抗病毒活性,其合成路線如下:
已知:①![]() +HCHO+
+HCHO+
![]()

②RX![]() RLiX
RLiX![]() RSH
RSH
請回答:
(1)下列說法正確的是___________。
A.化合物A能發生加成、取代和氧化反應,不發生還原反應
B.化合物B具有弱堿性
C.化合物D與FeCl3溶液發生顯色反應
D.阿比朵爾的分子式是C22H25N2O3BrS
(2)寫出化合物D的結構簡式___________。
(3)寫出G→阿比朵爾的化學方程式___________。
(4)設計從E→F的合成路線(用流程圖表示,無機試劑任選)___________。
(5)寫出化合物A同時符合下列條件的同分異構體的結構簡式___________。
①1H-NMR譜和IR譜檢測表明:分子中共有4種氫原子,含氮氧單鍵和碳氧雙鍵;
②含有苯環和含氮五元雜環,且兩環共棱連接。
查看答案和解析>>
科目: 來源: 題型:
【題目】將3. 84 g銅粉與一定質量濃硝酸反應,當銅完全作用時,溶液中的NO3-減少0.1mol,則所消耗硝酸的物質的量是
A.0.1 molB.0.11 molC.0.16 molD.0.22 mol
查看答案和解析>>
科目: 來源: 題型:
【題目】乙酰基二茂鐵常用作火箭燃料添加劑、汽油抗爆劑等。某興趣小組制備乙酰基二茂鐵,流程如下:

已知:
a.反應原理:![]() +(CH3CO)2O
+(CH3CO)2O![]() CH3COOH+
CH3COOH+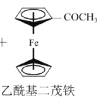
b.二茂鐵熔點173℃,沸點249℃,100℃易升華。
c.乙酰基二茂鐵熔點81℃,沸點163℃。不溶于水,易溶于有機溶劑。
請回答:
(1)步驟I,在50 mL圓底燒瓶中,加入新制的、經提純后0.5 g二茂鐵,5 mL乙酸酐,在振搖下滴入1 mL 85%磷酸,提純二茂鐵的方法為_______________。
(2)步驟II,加料畢,用裝填有CaCl2的干燥管塞住圓底燒瓶瓶口。如圖所示,其目的是__________。

(3)步驟IV,反應完畢后,將紫色混合物傾入含40 g碎冰燒杯中,并用10 mL冷水洗滌燒瓶,將洗滌液并入燒杯,在攪拌下加入NaHCO3(s),判斷溶液呈中性的實驗方法為__________。
(4)步驟V,包括結晶、吸濾、洗滌、干燥等多步操作。下列說法正確的是__________。
A.為較快地析出晶體,可以用玻璃棒摩擦燒杯內壁
B.吸濾裝置由吸濾瓶、布氏漏斗、抽氣泵組成
C.宜用乙醇洗滌,洗滌后乙醇易揮發
D.可在100℃紅外燈下干燥
(5)①粗產品中含有雜質為___________,可以用來鑒別的儀器是___________。
②分離提純粗產品后,用薄層層析來測定Rf值。選出其正確操作并按序列出字母:a→c→_______→_______→________→_________→g。
a.制備薄層色譜板
b.用少量純二茂鐵和提純后的產品分別溶于2 mL甲苯中,配成濃溶液
c.用細玻璃管拉制兩根微量滴管(尖端處約0.7mm)
d.將色譜板插入盛有乙醚的槽內,蓋上蓋子
e.待溶劑上升到色譜板3/4高度時,取出色譜板,并標記溶劑所到高度
f.分別用微量滴管浸入兩濃溶液,在色譜板兩原點處點樣,待干燥后,再重復點樣
g.計算Rf值
查看答案和解析>>
科目: 來源: 題型:
【題目】碳在冶金工業上具有重要用途。已知氧與碳的反應主要有:
Ⅰ.C(s)+O2(g)CO2(g) △H1=-394kJ·mol-1
Ⅱ.2C(s)+O2(g)2CO(g) △H2=-221kJ·mol-1
Ⅲ.2CO(g)+O2(g)2CO2(g) △H3
上述反應的△G~T如圖所示,且滿足△G=△H-T△S。
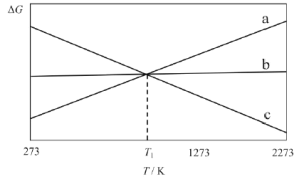
請回答:
(1)曲線a代表反應_________(填“I”、“II”或“III”),理由是__________。
(2)研究發現,以CO2替代高溫水蒸氣作為煤氣化反應(H2O與C反應)的氣化劑,實現了CO2零排放的新工藝。寫出反應IV的熱化學方程式___________(碳的計量數為1)。在1273K時,測得碳轉化率[α(C)]與時間t變化如圖所示。保持其它條件不變,請畫出1773K時α(C)~t關系圖______。
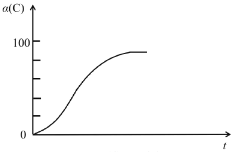
(3)當T=T1時,反應IV處于平衡狀態,下列關于反應IV的說法正確的是_________。
A.因平衡時△G=0,若△H變化173.3kJ·mol-1,△S變化173.3J·K-1·mol-1,計算得T1=1000K
B.T<T1時,反應向逆反應方向移動
C.當碳的濃度不再變化時,一定處于平衡狀態
D.因平衡常數K的值不再變化,反應達到了平衡
(4)當T=1273K時,僅存在CO、CO2兩種氣體,且維持總壓為1 atm,此時反應IV的Kp=112,則CO氣體所占的分壓p(CO)為___________atm。(列式即可)
查看答案和解析>>
科目: 來源: 題型:
【題目】乙二酸,又稱草酸,通常在空氣中易被氧化而變質。其兩分子結晶水(H2C2O4·2H2O)卻能在空氣中穩定存在。在分析化學中常用H2C2O4·2H2O做KMnO4的滴定劑,下列關于H2C2O4的說法正確的是
A.草酸是二元弱酸,其電離方程式為H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4屬于中和滴定,可用石蕊做指示劑
C.乙二酸可通過乙烯經過加成、水解、氧化再氧化制得
D.將濃H2SO4滴加到乙二酸上使之脫水分解,分解產物是CO2和H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】下列說法正確的是( )
A.2-丁烯不存在順反異構體
B.已知丙烷的二氯代物有四種異構體,則其六氯代物的異構體數目為六種
C.菲的結構簡式為 ,它與硝酸反應,可生成4種一硝基取代物
,它與硝酸反應,可生成4種一硝基取代物
D.乙醛的核磁共振氫譜中有二個峰,峰面積之比是1:3
查看答案和解析>>
科目: 來源: 題型:
【題目】A,B,C,D,E均為有機化合物,A是分子式為C5H10O的直鏈化合物,B與NaHCO3溶液完全反應,其物質的量之比為1:2,它們之間的關系如圖所示(提示:RCH=CHR′在酸性高錳酸鉀溶液中反應生成RCOOH和R′COOH,其中R和R′為烷基).下列敘述錯誤的是( )
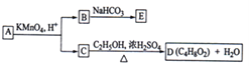
A.B的結構簡式為HOOCCH2COOHB.C與乙醇發生了酯化反應
C.A可以與氫氧化鈉溶液發生中和反應D.E的分子式為C3H2O4Na2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com