
科目: 來源: 題型:
【題目】某興趣小組設計如下微型實驗裝置。實驗時,現斷開K2,閉合K1,兩極均有氣泡產生;一段時間后,斷開K1,閉合K2,發現電流表指針偏轉,下列有關描述正確的是

A. 斷開K2,閉合K1時,總反應的離子方程式為:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 斷開K2,閉合K1時,石墨電極附近溶液變紅
C. 斷開K1,閉合K2時,銅電極上的電極反應為:Cl2+2e—=2Cl—
D. 斷開K1,閉合K2時,石墨電極作正極
查看答案和解析>>
科目: 來源: 題型:
【題目】某充電寶鋰離子電池的總反應為:xLi+Li1-xMn2O4 ![]() LiMn2O4,某手機鎳氫電池總反應為: NiOOH+MH ==== M+Ni(OH)2(M為充電儲氧金屬或合金),有關上述兩種電池的說法不正確的是( )
LiMn2O4,某手機鎳氫電池總反應為: NiOOH+MH ==== M+Ni(OH)2(M為充電儲氧金屬或合金),有關上述兩種電池的說法不正確的是( )
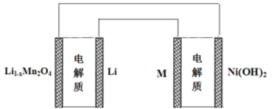
A. 鋰離子電池放電時Li+向正極遷移
B. 鎳氫電池放電時,正極的電極反應式NiOOH+H2O+e-Ni(OH)2+OH-
C. 上圖表示用鋰離子電池給鎳氫電池充電
D. 鋰離子電池充電時,陰極的電極反應式LiMn2O4-xe-=Li1-xMn2O4+xLi+
查看答案和解析>>
科目: 來源: 題型:
【題目】硼酸在生活中應用廣泛,H3BO3可以通過電解NaB(OH)4溶液的方法制備,其工作原理如圖,a、c為陽離子交換膜,且H+可B(OH)4-與反應生成H3BO3,下列敘述錯誤的是( )
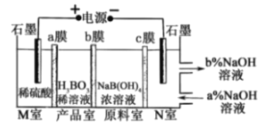
A. M室發生的電極反應式為:2H2O-4e-=O2↑+4H+
B. N室中:a%<b%
C. b膜為陰離子交換膜,產品室發生反應的化學原理為強酸制弱酸
D. 理論上每生成1mol產品,陰極室可生成標準狀況下5.6L氣體
查看答案和解析>>
科目: 來源: 題型:
【題目】室溫下,下列各組離子在指定溶液中能大量共存的是( )
A.能使酚酞變紅的溶液:Na+、Al3+、SO42-、NO3-
B.![]() =10-12的溶液:NH4+、Na+、SO42-、Cl-
=10-12的溶液:NH4+、Na+、SO42-、Cl-
C.0.1 mol·L-1Na2SO3溶液:NH4+、K+、ClO-、Cl-
D.0.1 mol·L-1 FeCl3溶液:Mg2+、Al3+、MnO4-、SCN-
查看答案和解析>>
科目: 來源: 題型:
【題目】一種以硼鎂礦(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)為原料生產硼酸(H3BO3)及輕質氧化鎂的工藝流程如下:
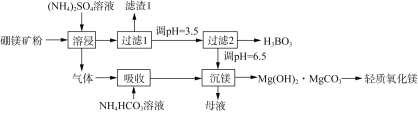
回答下列問題:
(1)“溶浸”硼鎂礦粉過程中,提高B、Mg元素的浸出率可以采用什么措施________(填寫兩點)。
(2)“溶浸”后產生的氣體是__________(填化學式)。
(3)為檢驗“過濾1”后的濾液中是否含有Fe3+,可選用的化學試劑是______________溶液(填化學式)。
(4)根據H3BO3的解離反應:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×10-10,寫出H3BO3與NaOH反應的離子方程式________________________________________。
H++B(OH)4,Ka=5.81×10-10,寫出H3BO3與NaOH反應的離子方程式________________________________________。
(5)寫出“沉鎂”中生成Mg(OH)2·MgCO3沉淀的離子方程式以及將堿式碳酸鎂高溫灼燒制備輕質氧化鎂的化學方程式________________、____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室以廢銅屑(含少量Fe、不溶性雜質)為原料制取CuSO4·5H2O晶體和[Cu(NH3)4]SO4·H2O晶體,其實驗流程如下:
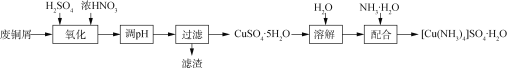
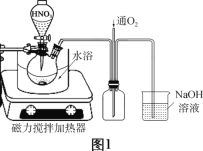
(1)氧化時先加入一定量3 mol/L H2SO4,再調節濃硝酸的用量至![]() 為2.0左右時,銅粉和濃硝酸完全反應,主要反應的化學方程式為_______。
為2.0左右時,銅粉和濃硝酸完全反應,主要反應的化學方程式為_______。
硝酸過量對產品的影響為________________________________。
(2)廢銅屑的氧化在如圖1所示的裝置中進行。從長導管中通入氧氣的作用是___________。保持試劑的用量不變,實驗中提高Cu轉化率的操作有____________(寫一種)。
(3)調節溶液pH應在3.5~4.5范圍的原因是______________________。
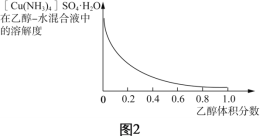
(4)已知:[Cu(NH3)4]2+![]() Cu2++4NH3;CuSO4、(NH4)2SO4難溶于乙醇。結合圖2,[Cu(NH3)4]SO4·H2O在乙醇水混合液中的溶解度隨乙醇濃度變化曲線,補充完整由加足量氨水后所得的[Cu(NH3)4]SO4溶液制備[Cu(NH3)4]SO4·H2O晶體的實驗方案:______________ (實驗中必須使用的試劑和儀器:無水乙醇、乙醇-水混合液、BaCl2溶液、真空干燥箱)。
Cu2++4NH3;CuSO4、(NH4)2SO4難溶于乙醇。結合圖2,[Cu(NH3)4]SO4·H2O在乙醇水混合液中的溶解度隨乙醇濃度變化曲線,補充完整由加足量氨水后所得的[Cu(NH3)4]SO4溶液制備[Cu(NH3)4]SO4·H2O晶體的實驗方案:______________ (實驗中必須使用的試劑和儀器:無水乙醇、乙醇-水混合液、BaCl2溶液、真空干燥箱)。
查看答案和解析>>
科目: 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列說法中正確的是
A.4.0g重水(D2O)中所含質子數為0.4NA
B.4.48L N2與CO的混合物中所含分子數為0.2NA
C.常溫下,7.1g Cl2與足量NaOH溶液反應轉移的電子數約為0.1NA
D.0.2mol Na2O2中含有離子總數為0.8NA
查看答案和解析>>
科目: 來源: 題型:
【題目】已知有位于元素周期表前四周期的元素X、Y、Z、T、W、Q,其部分信息如下表:
X | 宇宙中含量最豐富的元素 |
Y | 植物生長所必需的三種營養元素中,電負性最大的 |
Z | 原子最外層電子數是其電子層數的3倍 |
Q | 其氣態氫化物與其低價氧化物常溫下能反應,生成該元素的單質 |
T | 最高正價與最低負價代數和為6,其單質能與強堿溶液反應制消毒液 |
W | 其+2價陽離子的價電子排布為3d9 |
請回答下列問題:
(1)W元素位于周期表的第___周期___族,W2+能與X、Y形成的簡單分子結合生成一種深藍色的離子,其離子符號為___。
(2)X與Z按原子個數比為1:1組合得到的一種物質甲,它能用于殺菌消毒,物質甲的電子式為___;Q與T也能按原子個數比為1:1組合,得到一種暗黃色的液體乙,其結構與甲相似,則乙中存在的化學鍵類型有___和___;乙遇水發生歧化反應,得到一種淡黃色的固體和兩種具有刺激性氣味的氣體,該反應的化學反應方程式為___。
(3)元素Q的簡單離子半徑___元素T的簡單離子半徑(填“>”“<”或“=”);元素T能形成多種含氧酸:HTO、HTO2、HTO3、HTO4,其酸性由強到弱的順序為___(用化學式表示)。
查看答案和解析>>
科目: 來源: 題型:
【題目】2019年是元素周期表發表150周年,期間科學家為完善周期表做出了不懈努力。中國科學院院士張青蓮教授曾主持測定了銦(49In)等9種元素相對原子質量的新值,被采用為國際新標準。銦與硼(5B)同主族,與銣(37Rb)同周期。下列說法不正確的是
A.In是第五周期第ⅢA族元素B.![]() 的中子數與電子數的差值為17
的中子數與電子數的差值為17
C.原子半徑:In>AlD.堿性:In(OH)3>RbOH
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖所涉及的物質均為中學化學中的常見物質,其中C、D、E為單質,E為固體,F為有磁性的化合物。它們之間存在如下關系(反應中生成的水及次要產物均已略去):
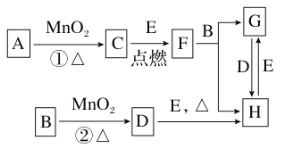
(1)寫出下列物質的化學式:B________,E________。
(2)指出MnO2在相關反應中的作用:反應①中是________劑,反應②中是________劑。
(3)若反應①是在加熱條件下進行,則A是________(填化學式);若反應①是在常溫條件下進行,則A是________(填化學式);如在上述兩種條件下得到等質量的C單質,反應中轉移的電子數之比為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com