
科目: 來源: 題型:
【題目】下列關于氯水的說法正確的是( )
A. 新制氯水含有Cl2、HCl、HClO、H2O分子
B. 紫色石蕊試劑滴入新制氯水中,溶液先變紅后變無色
C. 氯水和液氯都能使干燥的有色布條褪色
D. 新制氯水的pH值要比久置氯水的pH值小
查看答案和解析>>
科目: 來源: 題型:
【題目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
則反應Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目: 來源: 題型:
【題目】用如圖電解裝置將霧霾中的SO2、NO轉化為(NH4)2SO4,用其作為一種優良的氮肥。下列有關說法正確的是
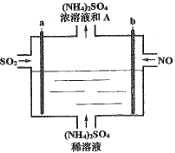
A.每處理lmol NO可以生成2mol A
B.a與電源負極相連,發生還原反應
C.通電后陽極附近溶液的pH增大
D.理論上將SO2與NO以體積比2∶5通入裝置可徹底轉化
查看答案和解析>>
科目: 來源: 題型:
【題目】從元素化合價和物質類別兩個角度學習、研究物質的性質,是一種行之有效的方法。以下是氮元素形成物質的價類二維圖的及氮的循環的部分信息。
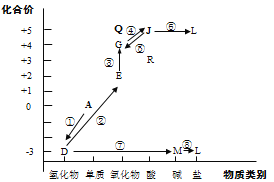
(1)①是一種人工固氮的重要途徑,該反應的化學方程式是__________。
(2)②的化學方程式是__________。
(3)⑤的化學方程式是(任寫一種)__________。
(4)R可與 NaOH溶液反應:HNO2+NaOH=NaNO2+H2O,該反應體現了R(HNO2)的_____性。
(5)Q的化學式是_______,Q屬于酸性氧化物,寫出Q與水反應的化學方程式________。
(6)L在水體中過多蓄積會導致水體富營養化。將水體調節為酸性后加入適量NaClO,可將L中陽離子轉化為無污染氣體以去除。寫出L與NaClO反應的離子方程式_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】某小組同學欲探究H2O2的性質,經歷如下探究過程:
預測:聚焦H2O2中的O作為核心元素,因此預測H2O2既具有氧化性,也具有還原性。
(1)預測其具有氧化性的思路是_________。
實驗和觀察:小組同學分別選用酸性KMnO4溶液、酸化的KI溶液與5% H2O2溶液反應以驗證預測。
實驗① 實驗②
實驗②
(2)實驗①利用了酸性高錳酸鉀的_________ 性質,該實驗中,證明KMnO4溶液與H2O2反應的現象除了溶液顏色變淺或褪色外,還有________。
(3)實驗②是為了驗證H2O2的_________ 性質,在反應后的溶液中加入淀粉溶液,可觀察到溶液變藍,寫出該反應的離子方程式____________。
解釋和結論:
(4)以上實驗可得出的結論是______________________ 。
查看答案和解析>>
科目: 來源: 題型:
【題目】常溫下,用AgNO3溶液分別滴定濃度均為0.01mol/L KCl、K2C2O4溶液,所得的沉淀溶解平衡圖像如圖所示(不考慮C2O42-的水解)。已知Ksp(AgCl)數量級為1010。下列敘述正確的是
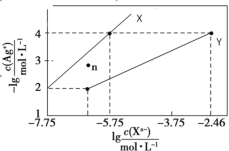
A.圖中X線代表的Ag2C2O4
B.n點表示Ag2C2O4的過飽和溶液
C.向c(Cl)=c(C2O42-)的混合液中滴入AgNO3溶液時,先生成AgCl沉淀
D.Ag2C2O4+2Cl=2AgCl+ C2O42-的平衡常數為100.71
查看答案和解析>>
科目: 來源: 題型:
【題目】研究表明N2O與CO在Fe+作用下發生可逆反應的能量變化及反應歷程如圖所示。下列說法不正確的是

A.反應中Fe+是催化劑,FeO+是中間產物
B.當有14g N2生成時,轉移1mol e
C.升高溫度,總反應的平衡常數K減小
D.總反應速率由反應②的速率決定
查看答案和解析>>
科目: 來源: 題型:
【題目】4NH3+5O2![]() 4NO+6H2O,若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則下列關系表示正確的是 ()
4NO+6H2O,若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則下列關系表示正確的是 ()
A. 5v(NH3)=6v(O2)B. 5v(O2)=6v(H2O)
C. 2v(NH3)=2v(H2O)D. 4v(O2)=5v(NO)
查看答案和解析>>
科目: 來源: 題型:
【題目】對可逆反應4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列敘述正確的是( )
4NO(g)+6H2O(g),下列敘述正確的是( )
A. 達到化學平衡時4v正(O2)=5v逆(NO)
B. 若單位時間內生成x mol NO的同時,消耗x mol NH3,則反應達到平衡狀態
C. 達到化學平衡時,若增大容器容積,則正反應速率減小,逆反應速率增大
D. 化學反應速率關系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目: 來源: 題型:
【題目】堿性鋅錳電池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的電解質溶液是KOH溶液。某課題組用廢舊鐵殼無汞堿性鋅錳電池為原料,制備一種新型材料MnxZn(1-x)Fe2O4,其工藝流程如圖所示:
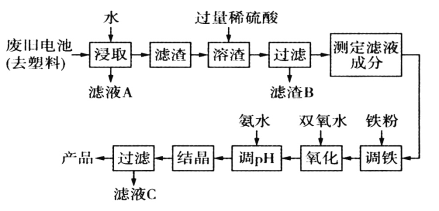
(1)濾液A中溶質的電子式為____________。
(2)已知MnxZn(1-x)Fe2O4中錳元素的化合價與實驗室用二氧化錳制取氯氣時還原產物中錳元素的化合價相同,則鐵元素的化合價為_________。
(3)“溶渣”工序中稀硫酸與鐵反應生成的硫酸亞鐵可將+3價錳的化合物全部還原成Mn2+,寫出該反應的離子方程式:_____________________________。
(4)“調鐵”工序的目的是調整濾液中鐵離子的總濃度,使其中金屬元素的物質的量之比與產品的化學式MnxZn(1-X)Fe2O4相符合。
①寫出“調鐵"工序中發生反應的離子方程式:_________________,___________________。
②若測得濾液的成分為c(Mn2+)+c(Zn2+)=amol.L-1,c(Fe2+)+c(Fe3+)=bmol.L-1,濾液體積為1m3,“調鐵”工序中,需加入的鐵粉質量為________kg(忽略溶液體積變化,用含a、b的代數式表示)。
(5)在“氧化"工序中,加入雙氧水的目的是把Fe2+氧化為Fe3+;生產過程中發現實際消耗雙氧水的量大于理論值,其可能原因除溫度外,主要是_______________。
(6)用氨水“調pH"后,經“結晶”“過濾”可得到產品和濾液C,從濾液C中還可分離出一種氮肥,該氮肥的溶液中的離子濃度由小到大的順序為_____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com