
科目: 來源: 題型:
【題目】據報道,以硼氫化合物NaBH4(B元素的化合價為+3價)和H2O2作原料的燃料電池,其負極材料采用Pt/C,正極材料采用MnO2,可用作空軍通信衛星電源,其工作原理如圖所示。下列說法正確的是
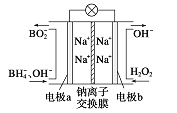
A. 該電池的負極反應為BH4-+8OH--8e-=BO2-+6H2O
B. 電池放電時Na+從b極區移向a極區
C. 每消耗3 mol H2O2,轉移的電子為3 mol
D. 電極a采用MnO2作電極材料
查看答案和解析>>
科目: 來源: 題型:
【題目】一定溫度下,向容積為2 L的密閉容器中通入兩種氣體發生化學反應,反應中各物質的物質的量變化如下圖所示,對該反應的推斷合理的是( )

A. 該反應的化學方程式為3B+4D![]() 6A+2C
6A+2C
B. 反應進行到1 s時,v(A)=v(D)
C. 反應進行到6 s時,B的平均反應速率為0.05 mol/(L·s)
D. 反應進行到6 s時,各物質的反應速率相等
查看答案和解析>>
科目: 來源: 題型:
【題目】短周期主族元素W、X、Y、Z的原子序數依次增大,原子最外層電子數之和為17。其中W、X、Y三種元素的簡單離子的核外電子排布相同,且可形成結構如圖所示的化合物。下列說法正確的是( )
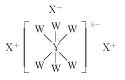
A.原子半徑:Z>Y>X>W
B.X與Z形成的化合物會抑制水的電離
C.X、Z均能形成兩種常見氧化物
D.W的最高價氧化物對應水化物的酸性最強
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖是某同學設計用來驗證SO2性質的微型實驗裝置。分析實驗,下列結論不正確的是( )
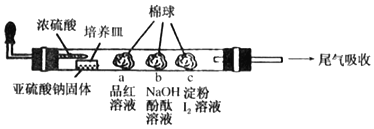
A.棉球a褪色,說明SO2具有漂白性
B.棉球b褪色,說明SO2具有氧化性
C.棉球c褪色,說明SO2具有還原性
D.可以用氨水或高錳酸鉀溶液吸收尾氣
查看答案和解析>>
科目: 來源: 題型:
【題目】《本草圖經》有“白礬多人藥用”。白礬[KAl(SO4)2·12H2O]又稱明礬.鉀鋁礬、鉀明礬等,是一種重要的化學試劑。下列說法正確的是( )
A.含白礬的藥物不宜與胃藥奧美拉唑碳酸氫鈉膠囊同時服用
B.0.1molL-1白礬溶液完全水解生成Al(OH)3膠粒數小于6.02×1022
C.向含0.1mol白礬的溶液中滴入Ba(OH)2溶液,若SO42-和Al3+全部轉化為BaSO4和Al(OH)3沉淀,則此時生成沉淀的質量最大
D.室溫下,0.1molL-1白礬溶液中水電離出c(H+)小于10-7mol·L-1
查看答案和解析>>
科目: 來源: 題型:
【題目】利用下列裝置模擬“侯氏制堿法”,通過制備的NH3和CO2,與飽和食鹽水反應先制備NaHCO3。下列說法正確的是( )
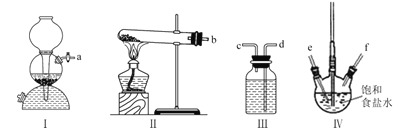
A.實驗時裝置I產生的氣體應先通人到裝置IV中
B.裝置II中的試劑為濃硫酸
C.導管口的連接順序為a-e-f-d-c-b
D.實驗過程中,裝置IV內會出現渾濁現象
查看答案和解析>>
科目: 來源: 題型:
【題目】有一種無色溶液,可能含有以下離子中的若干種:Na+、NH4+、Cl﹣、Ba2+、HCO3﹣、SO42﹣,現取兩份100mL的該溶液進行如下實驗:
(1)第1份加足量NaOH溶液并加熱,收集到標準狀況下的氣體672mL
(2)第2份加足量Ba(OH)2溶液,得沉淀6.27g,再用足量鹽酸洗滌、干燥,得沉淀2.33g
根據上述實驗,下列推測正確的是( )
A.該溶液中一定有Ba2+
B.c(NH4+)為0.3molL﹣1
C.100mL該溶液中含0.01 mol HCO3﹣
D.原溶液中c(Na+)和c(SO42﹣)的比值大于等于1
查看答案和解析>>
科目: 來源: 題型:
【題目】如圖所示,將鐵棒和石墨棒插入1 L 1 mol/L食鹽水中。下列說法正確的是( )
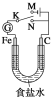
A. 若電鍵K與N連接,鐵被保護不會腐蝕
B. 若電鍵K與N連接,正極反應式是4OH--4e-===2H2O+O2↑
C. 若電鍵K與M連接,將石墨棒換成銅棒,可實現鐵棒上鍍銅
D. 若電鍵K與M連接,當兩極共產生28 L(標準狀況)氣體時,生成了1 mol NaOH
查看答案和解析>>
科目: 來源: 題型:
【題目】含釩石煤(含有鐵、硅、鋁、鈣、鎂等元素的氧化物)中的釩大部分是以V(III)和V(IV)形式存在,由含礬石煤提釩的一種工藝流程如圖所示:

已知:銅鐵試劑能與銅、鐵、鋁、鈦等元素形成不溶于水的配合物。
回答下列問題:
(1)含礬石煤預制時加入復合添加劑對釩浸出率的影響如圖所示,其中最佳復合添加劑為__,最佳添加比例為__。

(2)如圖為“抽濾”實驗原理裝置圖,"抽濾”時抽氣泵的作用是__;“酸浸渣”經“水洗滌”返回“浸出”的目的是__。

(3)已知酸浸液中V2O24+被H2O2氧化成VO2+,其離子方程式為__。“凈化除雜”時用銅鐵試劑除去所含的Al3+、Fe3+等雜質離子而不通過調節酸浸液pH的原因是__。
(4)“沉釩”的離子反應方程式為___。
(5)“煅燒”純凈的沉釩產物過程中,固體殘留率與溫度變化如圖所示。已知A點坐標為(260℃,85.47%)。則A點對應物質的化學式為__,B點對應的物質為V2O5,則B點坐標為___。

查看答案和解析>>
科目: 來源: 題型:
【題目】硫酸銅晶體常用做農業和漁業的殺蟲劑、殺菌劑。實驗室模擬由廢銅屑(含少量鐵)生產硫酸銅晶體的流程如圖:
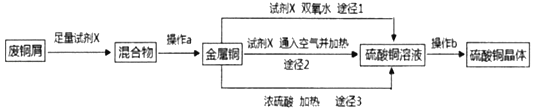
(1)試劑X是_____,操作a需要的玻璃儀器有燒杯、玻璃棒和_____。
(2)途徑1是將銅加入到試劑X與雙氧水的混和液中并用30~40℃水浴加熱,該過程中溫度不宜過高的原因是_____。
(3)途徑2是將銅加入到試劑X中,再通入足量的空氣并加熱,該反應的化學方程式為_____。
(4)從環保和經濟的角度對比途徑1與途徑3,途徑1的優點有_____、_____。
(5)操作b包括蒸發濃縮、_____、過濾、冼滌、干燥(請補全缺少的實驗步驟)。
(6)硫酸銅晶體(CuSO4xH2O)中結晶水數目可通過以下實驗測定:
Ⅰ.稱取4.6400g樣品置于小燒杯中,加入適量水溶解,邊攪拌邊滴加BaCl2溶液到沉淀完全
Ⅱ.過濾并洗滌沉淀;
Ⅲ.將盛有沉淀的濾紙包烘干并高溫灼燒,再轉入高溫爐中,一定溫度下反復灼燒到恒重,得到BaSO4質量為4.6600g。計算CuSO4xH2O中的x值(要求寫出計算過程)_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com