
科目: 來源: 題型:
【題目】Ⅰ.已知:①![]()
②![]()
③![]()
試據此寫出一氧化碳燃燒的熱化學方程式___________________________。
Ⅱ.某同學設計一個燃料電池(如圖所示),目的是探究氯堿工業原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜。根據要求回答相關問題:
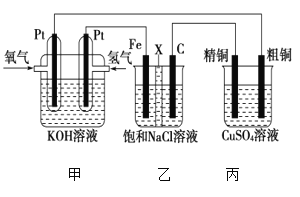
①石墨電極為________(填“陽極”或“陰極”),反應一段時間后,在乙裝置中滴入酚酞溶液,________(填“鐵極”或“石墨極”)區的溶液先變紅。乙池中電解總方程式為____________。
②如果粗銅中含有鋅、銀等雜質,丙裝置中反應一段時間,溶液中硫酸銅濃度將________(填“增大”“減小”或“不變”)。精銅電極上的電極反應式為______________________。
③若在標準狀況下,有224 mL氧氣參加反應,則乙裝置中鐵電極上生成的氣體在標準狀況下體積為________mL;丙裝置中陰極析出銅的質量為________g。
查看答案和解析>>
科目: 來源: 題型:
【題目】結構簡式如圖所示的有機物常用于合成藥物,下列對該有機物說法不正確的是
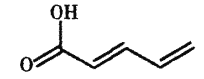
A.存在順反異構體
B.與丙烯酸互為同系物
C.有兩種官能團
D.與H2按等物質的量關系反應時,可能有3種加成產物
查看答案和解析>>
科目: 來源: 題型:
【題目】對于100mL0.5 mol·L-1Na2CO3溶液,下列有關說法正確的是( )
A.實驗室配制該溶液,定容時仰視刻線,所配制溶液濃度偏大
B.該溶液稀釋10倍后,c(Na+)=0.05 mol·L-1
C.從該溶液中取出10mL,所取溶液中溶質的物質的量濃度為0.05 mol·L-1
D.該溶液中含有Na2CO3的質量為5.3g
查看答案和解析>>
科目: 來源: 題型:
【題目】某種電鍍污泥主要含有碲化亞銅(Cu2Te)、三氧化二鉻(Cr2O3)以及少量的金(Au),可用于制取Na2Cr2O7溶液、金屬銅和粗碲等,以實現有害廢料的資源化利用,工藝流程如下:
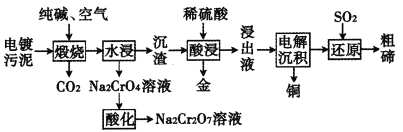
已知:煅燒時,Cu2Te發生的反應為Cu2Te+2O2![]() 2CuO+TeO2。
2CuO+TeO2。
(1)Te元素在元素周期表中的位置為______________其基態原子的電子占據的最高能層符號為________。
(2)煅燒時,Cr2O3發生反應的化學方程式為__________________。
(3)浸出液中除了含有TeOSO4(在電解過程中不反應)外,還可能含有________(填化學式)。電解沉積過程中析出單質銅的電極為_________極。
(4)工業上用重鉻酸鈉(Na2Cr2O7)母液生產重鉻酸鉀(K2Cr2O7)的工藝流程如圖所示:
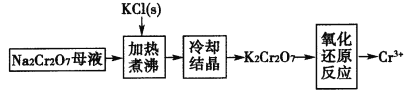
通過冷卻結晶能析出大量K2Cr2O7的原因是______________。
(5)測定產品中K2Cr2O7含量的方法如下:稱取試樣2.50 g配成250 mL溶液,取25.00 mL于錐形瓶中,加入足量稀硫酸和幾滴指示劑,用0.1000 mol·L-1(NH4)2Fe(SO4)2標準液進行滴定。滴定過程中發生反應的離子方程式為____________________。
若三次實驗消耗(NH4)2Fe(SO4)2標準液的體積平均為25.00 mL,則所得產品中K2Cr2O7的純度為________%(保留三位有效數字)。
查看答案和解析>>
科目: 來源: 題型:
【題目】濃硫酸和銅在加熱時反應,生成SO2氣體的體積為3.36L(標準狀況下)。已知:Cu+2H2SO4(濃)![]() CuSO4+SO2↑+2H2O。試計算:(寫出計算過程)
CuSO4+SO2↑+2H2O。試計算:(寫出計算過程)
(1)SO2氣體的物質的量是多少?___
(2)參加反應的硫酸的物質的量是多少?___
(3)將生成的硫酸銅配制成500mL溶液,則該溶液中溶質的物質的量濃度是多少?___
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室用18.4molL-1的濃硫酸來配制480mL0.2molL-1的稀硫酸。可供選用的儀器有:①膠頭滴管②燒瓶③燒杯④藥匙⑤量筒⑥托盤天平⑦玻璃棒
請回答下列問題:
(1)配制稀硫酸時,上述儀器中不需要使用的有___(選填序號),還缺少的儀器有(寫儀器名稱)___。
(2)需要用量筒量取上述濃硫酸的體積為___mL,量取濃硫酸時應選用___(選填①10mL②50mL③100mL)規格的量筒。
(3)實驗中兩次用到玻璃棒,其作用分別是:___、___。
(4)下列對容量瓶及其使用方法的描述中正確的是___。
A.容量瓶上標有容積、溫度和濃度
B.容量瓶用蒸餾水洗凈后,必須烘干
C.配制溶液時,把量好的濃硫酸小心倒入容量瓶中,加入蒸餾水到接近刻度線1~2cm處,改用膠頭滴管加蒸餾水至刻度線
D.使用前要檢查容量瓶是否漏水
(5)在配制過程中,下列操作可引起所配溶液濃度偏低的有___(填序號)
①未洗滌稀釋濃硫酸時用過的燒杯和玻璃棒
②未等稀釋后的硫酸溶液冷卻至室溫就轉移到容量瓶中
③轉移前,容量瓶中含有少量蒸餾水
④定容時,仰視刻度線
查看答案和解析>>
科目: 來源: 題型:
【題目】物質的量是高中化學計算的核心:
(1)相同物質的量的NH3和H2S的質量比___,分子個數比為___,同溫同壓下的體積比__,所含氫原子的個數比為____.
(2)現有m g某氣體,它的一個分子由四原子構成,它的摩爾質量為M g/mol.設阿伏伽德羅常數為NA,則:
①該氣體的物質的量為____mol.
②該氣體中所含的原子總數為____個.
③該氣體在標準狀況下的體積為___L.
查看答案和解析>>
科目: 來源: 題型:
【題目】關于Na2CO3與NaHCO3的性質判斷正確的是( )
A.常溫下溶解度:Na2CO3<NaHCO3
B.熱穩定性:Na2CO3<NaHCO3
C.與同濃度同體積的鹽酸反應的速率:Na2CO3>NaHCO3
D.與澄清石灰水反應,均有白色沉淀生成
查看答案和解析>>
科目: 來源: 題型:
【題目】某種熔融碳酸鹽燃料電池以Li2CO3、K2CO3為電解質、以CH4為燃料時,該電池工作原理如圖,下列說法正確的是 ( )。

A. a為CH4,b為CO2
B. ![]() 向負極移動
向負極移動
C. 此電池在常溫時也能工作
D. 正極電極反應式為O2+2CO2+4e-===2![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com