
科目: 來源: 題型:
【題目】KMnO4是一種高效氧化劑可用來氧化吸附有機異味物.也可以與水中的雜質如二價鐵、錳、硫、氰、酚等反應。實驗室常用Na2C2O4標準溶液標定未知濃度的KMnO4溶液,發生反應:5C2O42-+2MnO4-+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根據以上信息,完成下列問題:
(1)按電子排布K位于元素周期表的_______區,基態Mn2+的核外電子排布式可表示為_____。
(2)1 mol [Mn( H2O)6]2+中所含有的共價鍵數目為__________。
(3)基態C原子的核外電子中占據最高能級的電子云輪廓圖為_______.C2O42-中碳原子的軌道雜化類型是___________________.
(4)同主族元素氧、硫、硒對應最簡單氫化物的沸點:H2O>H2Se>H2S,原因是__________。
(5)β-MnSe的結構中Se為面心立方最密堆積,晶胞結構如圖所示。
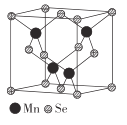
①β-MnSe中Mn的配位數為_____________。
②若該晶體的晶胞參數為apm,阿伏加德羅常數的值為NA。則距離最近的兩個錳原子之間的距離為______pm, β-MnSe 的密度ρ= ______ ( 列出表達式)g·cm-3。
查看答案和解析>>
科目: 來源: 題型:
【題目】在標準狀況下有①6.72L CH4,②3.01×1023個HCl分子,③13.6g硫化氫,④0.2mol氨氣(NH3)。下列對這四種氣體的關系從大到小描述不正確的是( )
A.體積②>③>①>④B.密度②>③>④>①
C.質量②>③>①>④D.氫原子數①>④>③>②
查看答案和解析>>
科目: 來源: 題型:
【題目】聯氨(N2H4)和次磷酸鈉(NaH2PO2)都具有強還原性.都有著廣泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ●mol-1
②N2O4(l)-=N2(g)+2O2(g) △H2=+204.3 kJ●mol-1
則火箭燃料的燃燒反應為2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=_____.
(2)已知反應N2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T°C時,向V L恒容密閉容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,測得Cl2和HCl的濃度隨時間的關系如圖所示。
N2(g)+4HCl(g),T°C時,向V L恒容密閉容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,測得Cl2和HCl的濃度隨時間的關系如圖所示。

①0~ 10 min內,用N2(g)表示的平均反應速率v(N2)=_______。
②M點時,N2H4的轉化率為______(精確到0.1)%。
③T °C時,達到平衡后再向該容器中加入1.2 mol N2H4(g)、0.4 mol Cl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此時平衡______(填“正向移動”“逆向移動”或“不移動”)。
(3)①在惰性氣體中,將黃磷(P4)與石灰乳和碳酸鈉溶液一同加入高速乳化反應器中制得NaH2PO2,同時還產生磷化氫(PH3)氣體,該反應的化學方程式為________________。
②次磷酸(H3PO2)是一元酸,常溫下.1.0 mol●L-1的NaH2PO2溶液pH為8,則次磷酸的Ka=___________。
③用次磷酸鈉通過電滲析法制備次磷酸.裝置如圖2所示。交換膜A屬于____(填“陽離子”或“陰離子”)交換膜,電極N的電極反應式為______,當電路中流過3.8528×105庫侖電量時.制得次磷酸的物質的量為_____ (一個電子的電量為 1.6×10- 19庫侖,NA數值約為6. 02× 1023)。

查看答案和解析>>
科目: 來源: 題型:
【題目】金屬鈦在航天、潛海和醫療方面應用廣泛。以鈦鐵礦[主要成分為鈦酸亞鐵(FeTiO3),含少量Fe2O3]為原料制備鈦的工藝流程如圖所示。
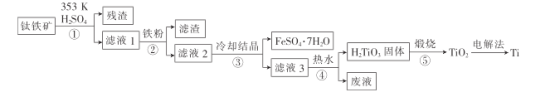
(1)步驟②、③、④中,均需進行的操作是_____________(填操作名稱)。
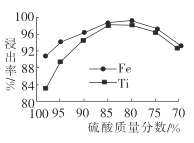
(2)濾液1中鈦元素以TiO2+形式存在,步驟①中生成TiO2+的化學方程式為__________,硫酸質量分數對鈦、鐵浸出率的影響如圖所示.據此判斷,酸浸時所加硫酸的質量分數應為______(填范圍)。.
(3)請結合離子方程式解釋步驟④中加熱水的原因:__________。
(4)電解法制備Ti的裝置是以石墨為陽極,TiO2為陰極,熔融CaO為電解質。Ti在_______(填“陽極”或“陰極”)生成,____(填“能”或“不能”)將熔融CaO換成石灰乳。
(5)以綠礬為原料,可以制備重要工業原料氧化鐵,基本流程如下:
![]()
①綠礬溶液中離子濃度由大到小的順序為__________。
②FeCO3達到沉淀溶解平衡時,室溫下測得溶液的pH為8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____(填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}
查看答案和解析>>
科目: 來源: 題型:
【題目】下列離子方程式中,正確的是 ( )
A.NH4HCO3溶液中加入過量的NaOH溶液并加熱:NH4++OH- ![]() NH3↑+H2O
NH3↑+H2O
B.銅和硝酸銀溶液反應:Cu+Ag+=Cu2++Ag
C.向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-離子恰好沉淀完全:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.NH4HCO3溶液與過量HCl溶液混合:HCO3-+H+=CO2↑+H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】有4種無色液態物質:己烯、己烷、苯和甲苯,符合下列各題要求的分別是:
(1)不能與溴水或KMnO4酸性溶液反應,但在鐵屑作用下能與液溴反應的是____,生成的有機物名稱是_____,反應的化學方程式為________,此反應屬于________反應。
(2)不能與溴水或KMnO4酸性溶液反應的是________。
(3)能與溴水和KMnO4酸性溶液反應的是________。
(4)不與溴水反應但能與KMnO4酸性溶液反應的是________。
查看答案和解析>>
科目: 來源: 題型:
【題目】物質有以下轉化關系:

根據上圖和實驗現象,回答下列問題:(用化學式表示)
(1)A是_____,X粉末是_______;
(2)寫出反應①的化學方程式___________________;
(3)寫出反應②的離子方程式___________________;
(4)寫出除去固體C中混有的NaHCO3的化學方程式____________。
查看答案和解析>>
科目: 來源: 題型:
【題目】家用液化氣的主要成分之一是丁烷,當10kg丁烷完全燃燒并生成二氧化碳和液態水時,放出熱量為5×105kJ,試寫出丁烷燃燒的熱化學方程式____________________,已知1mol液態水氣化時需要吸收44kJ的熱量,則反應![]() 的ΔH為____________________。
的ΔH為____________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】實驗室用MnO2和濃鹽酸制氯氣的反應為MnO2+4HCl(濃)![]() MnCl2+2H2O+Cl2↑。反應中,如果有17.4 g MnO2被還原,那么:
MnCl2+2H2O+Cl2↑。反應中,如果有17.4 g MnO2被還原,那么:
(1)產生的Cl2在標準狀況下的體積為__________;
(2)轉移電子的物質的量為_______________;
(3)紡織工業中常用氯氣作漂白劑,漂白布匹后,過量的氯需要除去,通常可用Na2SO3作“脫氯劑”,脫氯后的產物為Na2SO4,氯變為-1價。若把本題中產生的Cl2完全轉化,需要Na2SO3的質量為____________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知某可逆反應:mA(g) + nB(g)![]() pC(g) H= Q kJ·mol-1,在密閉容器中進行,右圖表示在不同時間t、溫度T和壓強P與生成物C的百分含量的關系曲線,下列判斷正確的是
pC(g) H= Q kJ·mol-1,在密閉容器中進行,右圖表示在不同時間t、溫度T和壓強P與生成物C的百分含量的關系曲線,下列判斷正確的是
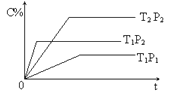
A. T1<T2 P1>P2 m+n<P Q<0B. T1>T2 P1<P2 m+n>P Q>0
C. T1<T2 P1<P2 m+n<P Q>0D. T1>T2 P1<P2 m+n>P Q<0
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com