
科目: 來源: 題型:
【題目】Na2S2O3應用廣泛,水處理中常用作還原劑、冶金中常用作絡合劑。
(1)Na2S2O3的實驗室制法:裝置如圖(加熱和夾持裝置略):

已知:2Na2S + 3SO2 = 2Na2SO3 + 3S↓ 、Na2SO3 + S = Na2S2O3
①甲中發生反應的化學方程式為______。
②實驗過程中,乙中的澄清溶液先變渾濁,后變澄清時生成大量的Na2S2O3。一段時間后,乙中再次出現少量渾濁,此時須立刻停止通入SO2。結合離子方程式解釋此時必須立刻停止通入SO2的原因:______。

③丙中,NaOH溶液吸收的氣體可能有______。
(2)實際工業生產中制得的Na2S2O3溶液中常混有少量Na2SO3,結合溶解度曲線(如圖),獲得Na2S2O35H2O的方法是______。
(3)Na2S2O3的用途:氨性硫代硫酸鹽加熱浸金是一種環境友好的黃金(Au)浸取工藝。
已知:I. Cu(NH3)42+=Cu2++4NH3;
II. Cu2+在堿性較強時受熱會生成CuO沉淀。
①將金礦石浸泡在Na2S2O3、Cu(NH3)42+的混合溶液中,并通入O2。浸金反應的原理為:
i.Cu(NH3)42+ + Au + 2S2O32![]() Cu(NH3)2+ + Au(S2O3)23+ 2NH3
Cu(NH3)2+ + Au(S2O3)23+ 2NH3
ii.4Cu(NH3)2+ + 8NH3+ O2 + 2H2O = 4Cu(NH3)42+ + 4OH
浸金過程Cu(NH3)42+起到催化劑的作用,金總反應的離子方程式為:______。

② 一定溫度下,相同時間金的浸出率隨體系pH變化曲線如如圖,解釋pH>10.5時,金的浸出率降低的可能原因_______。(寫出2點即可)
查看答案和解析>>
科目: 來源: 題型:
【題目】有機物X是藥物的中間體,它的一種合成路線如下。
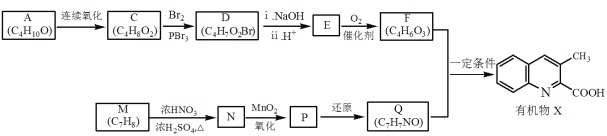
已知:RNH2+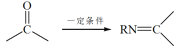 +H2O
+H2O
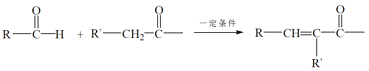
(1)A無支鏈,A中含有的官能團名稱是___。
(2)A連續氧化的步驟如下:
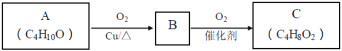
A轉化為B的化學方程式是___。
(3)M為芳香化合物,其結構簡式是___。
(4)M→N的化學方程式是___,反應類型是___。
(5)下列說法不正確的是___。
a.1molD與NaOH溶液反應時,最多消耗2molNaOH
b.E在一定條件下可生成高分子化合物 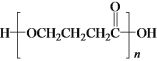
c.F能發生酯化反應和消去反應
(6)Q的結構簡式是___。
(7)以乙烯為起始原料,選用必要的無機試劑合成A,寫出合成路線___(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
查看答案和解析>>
科目: 來源: 題型:
【題目】鎂及其化合物一般無毒(或低毒)、無污染,且鎂原電池放電時電壓高而平穩,使鎂原電池越來越成為人們研制綠色原電池的關注焦點。其中一種鎂原電池的反應為xMg+Mo3S4![]() MgxMo3S4,下列說法正確的是( )
MgxMo3S4,下列說法正確的是( )
A.電池充電時,陰極發生還原反應生成Mo3S4
B.電池充電時,陽極反應為xMg-2xe-===xMg2+
C.電池放電時,Mg2+向負極遷移
D.電池放電時,正極反應為Mo3S4+2xe-+xMg2+=== MgxMo3S4
查看答案和解析>>
科目: 來源: 題型:
【題目】LED系列產品是被看好的一類節能新產品,下圖是一種氫氧燃料電池驅動LED發光的裝置。下列有關敘述正確的是
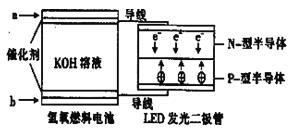
A.a處通入氫氣,發生了還原反應:H2-2e-+2OH-=2H2O
B.b處通入氧氣,為電池的正極
C.該裝置中只涉及兩種形式的能量轉化,電池中的KOH溶液也可用稀硫酸溶液代替
D.P-型半導體連接的是電池負極.
查看答案和解析>>
科目: 來源: 題型:
【題目】將反應Cu(s) + 2Ag+(aq)![]() Cu2+(aq) + 2Ag(s)設計成原電池,某一時刻的電子流向及電流計(G)指針偏轉方向如圖所示,有關敘述正確的是 ( )
Cu2+(aq) + 2Ag(s)設計成原電池,某一時刻的電子流向及電流計(G)指針偏轉方向如圖所示,有關敘述正確的是 ( )
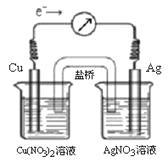
A. KNO3鹽橋中的K+移向Cu(NO3)2溶液
B. 當電流計指針為0時,該反應達平衡,平衡常數K=0
C. 若此時向AgNO3溶液中加入NaCl固體,隨著NaCl量的增加,電流計指針向右偏轉幅度減小→指針指向0→向左偏轉
D. 若此時向Cu(NO3)2溶液中加入NaOH固體,隨著NaOH量的增加電流計指針向右偏轉幅度減小→指針指向0→向左偏轉
查看答案和解析>>
科目: 來源: 題型:
【題目】周期表前四周期的元素![]() 、
、![]() 、
、![]() 、
、![]() ,原子序數依次增大,X原子基態時
,原子序數依次增大,X原子基態時![]() 層中
層中![]() 軌道電子數與s軌道電子數相同;
軌道電子數與s軌道電子數相同;![]() 原子基態時2p原子軌道上有3個未成對的電子;Z有多種氧化物,其中一種紅棕色氧化物可作涂料;
原子基態時2p原子軌道上有3個未成對的電子;Z有多種氧化物,其中一種紅棕色氧化物可作涂料;![]() 位于第四周期,其原子最外層只有1個電子,且內層都處于全充滿狀態。回答下列問題:
位于第四周期,其原子最外層只有1個電子,且內層都處于全充滿狀態。回答下列問題:
(1)X位于周期表的第_______周期,第______族。
(2)元素的第一電離能:X______Y(填“>”或“<”,下同);原子半徑:X______Y。
(3)![]() 的最高價氧化物對應水化物中酸根離子的空間構型是_______(用文字描述)。
的最高價氧化物對應水化物中酸根離子的空間構型是_______(用文字描述)。
(4)![]() 基態核外電子排布式為_________,用鐵氰化鉀溶液檢驗
基態核外電子排布式為_________,用鐵氰化鉀溶液檢驗![]() 的離子方程式為___________。
的離子方程式為___________。
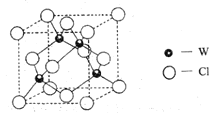
(5)元素W的一種氯化物晶體的晶胞結構如圖所示,該氯化物的化學式是_______,它可與濃鹽酸發生非氧化還原反應,生成配合物![]() ,反應的化學方程式:_________。
,反應的化學方程式:_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列化學用語正確的是
A. NaHCO3水解的離子方程式:HCO3-+ H2O![]() CO32-+H3O+
CO32-+H3O+
B. NH4Cl溶于D2O中:NH4++D2O![]() NH3·HDO+D+
NH3·HDO+D+
C. Na2S顯堿性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】十八大以來,各地重視“藍天保衛戰”戰略。作為煤炭使用大國,我國每年煤炭燃燒釋放出的大量SO2嚴重破壞生態環境。現階段主流煤炭脫硫技術通常采用石灰石-石膏法將硫元素以CaSO4的形式固定,從而降低SO2的排放。但是煤炭燃燒過程中產生的CO又會與CaSO4發生化學反應,降低脫硫效率。相關反應的熱化學方程式如下:
反應Ⅰ:CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
反應Ⅱ:CaSO4(s)+4CO(g) ![]() CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
請回答下列問題:
(1)反應CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g);△H=__________kJmol-1;該反應在________(填“高溫”“低溫”“任意溫度”)可自發進行。
(2)恒溫密閉容器中,加入足量CaSO4和一定物質的量的CO氣體,此時壓強為p0。tmin中時反應達到平衡,此時CO和CO2體積分數相等,CO2是SO2體積分數的2倍,則反應I的平衡常數Kp=________(對于氣相反應,用某組分B的平衡壓強p(B)代替物質的量濃度c(B)也可表示平衡常數,記作Kp,如p(B)=p·x(B),p為平衡總壓強,x(B)為平衡系統中B的物質的量分數)。
(3)圖1為1000K時,在恒容密閉容器中同時發生反應I和II,c(SO2)隨時間的變化圖像。請分析圖1曲線中c(SO2)在0~t2區間變化的原因___________________。

(4)圖2為實驗在恒容密閉容器中,測得不同溫度下,反應體系中初始濃度比![]() 與SO2體積分數的關系曲線。下列有關敘述正確的是______________________。
與SO2體積分數的關系曲線。下列有關敘述正確的是______________________。
A.當氣體的平均密度不再變化,反應I和反應Ⅱ同時達到平衡狀態
B.提高CaSO4的用量,可使反應I正向進行,SO2體積分數增大
C.其他條件不變,升高溫度,有利于反應I正向進行,SO2體積分數增大,不利于脫硫
D.向混合氣體中通入氧氣(不考慮與SO2反應),可有效降低SO2體積分數,提高脫硫效率
(5)圖1中,t2時刻將容器體積減小至原來的一半,t3時達到新的平衡,請在圖1中畫出t2-t3區間c(SO2)的變化曲線__________。
查看答案和解析>>
科目: 來源: 題型:
【題目】常溫下,分別調節濃度均為0.1 mol·L-1 HA溶液、HB的溶液的pH,所得溶液中酸分子的百分含量ω%(如HA的百分含量為![]() ×100%)與pH的變化關系如圖所示。已知調節pH時不影響溶液總體積。下列說法不正確的是
×100%)與pH的變化關系如圖所示。已知調節pH時不影響溶液總體積。下列說法不正確的是
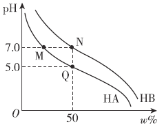
A.常溫下,Ka(HA)=1.0×10-5B.M、N兩點對應離子濃度:c(A-)=c(B-)
C.將M、N兩點溶液等體積混合,溶液呈中性D.水的電離程度:M=N>Q
查看答案和解析>>
科目: 來源: 題型:
【題目】25℃時,醋酸溶液中存在電離平衡:CH3COOH![]() CH3COO-+ H+,下列說法正確的是
CH3COO-+ H+,下列說法正確的是
A.向體系中加入少量CH3COONa固體,平衡向左移動,c(CH3COO-)下降
B.向體系中加水稀釋,平衡向右移動,溶液中所有離子的濃度都減小
C.加入少量NaOH固體(忽略溶解熱效應),平衡向右移動,水的電離程度也隨之增大
D.升高體系溫度(忽略醋酸揮發),溶液中H+數目增多,平衡一定向左移動
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com