
科目: 來源: 題型:
【題目】已知某氣體反應的平衡常數可表示為K=![]() ,該反應在不同溫度下的平衡常數:400℃,K=32;500℃,K=44。請回答下列問題:
,該反應在不同溫度下的平衡常數:400℃,K=32;500℃,K=44。請回答下列問題:
(1)寫出上述反應的化學方程式____。
(2)已知在密閉容器中,測得某時刻各組分的濃度如下:
物質 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
濃度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此時溫度400℃,則某時刻υ正____υ逆(填<、>或=,下同)。
②若以溫度為橫坐標,以該溫度下平衡態甲醇物質的量n為縱坐標,此時反應點在圖象的位置是圖中___點,比較圖中B、D兩點所對應的正反應速率υB_____υD,理由是____。

(3)一定條件下要提高反應物的轉化率,可以采用的措施是___。
a.升高溫度 b.加入催化劑 c.壓縮容器的體積 d.增加水蒸氣的濃度 e.及時分離出產物
查看答案和解析>>
科目: 來源: 題型:
【題目】某研究性學習小組為了測定某品牌鋁合金中鋁的含量,現設計了如下實驗:
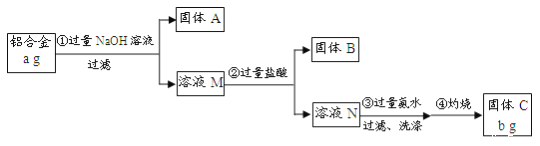
已知:該鋁合金的主要成分為Al2O3、MgO、CuO、SiO2;2NaOH+SiO2=Na2SiO3+H2O;Na2SiO3+
2HCl=2NaCl+H2SiO3↓。
請回答下列問題:
(1)固體A的成分是_______;
(2)步驟③中生成沉淀的離子方程式為_____;
(3)檢驗步驟③中沉淀是否洗滌干凈的實驗操作為______;
(4)該樣品中鋁的質量分數是______。(用a、b表示)
查看答案和解析>>
科目: 來源: 題型:
【題目】隨著鈷酸鋰電池的普及使用,從廢舊的鈷酸鋰電池中提取鋰、鈷等金屬材料意義重大。如圖是廢舊鉆酸鋰(LiCoO2)(含少量鐵、鋁、銅等元素的化合物)回收工藝流程:
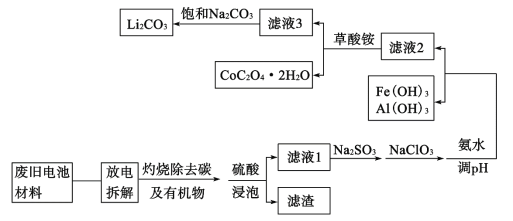
(1)“拆解”前需進入“放電”處理的目的是__;用食鹽水浸泡是放電的常用方法,浸泡放電過程中產生的氣體主要有__。
(2)上述流程中將CoO2-轉化為Co3+的離子方程式為__。
(3)濾液1中加入Na2SO3的主要目的是__;加入NaClO3的主要目的是__。
(4)“沉鈷”過程中,(NH4)2C2O4的加入量(圖a)、沉淀反應的溫度(圖b)與鈷的沉淀率關系如圖所示:

根據圖沉鈷時應控制n(C2O42-):n(Co2+)比為__,溫度控制在__℃左右。
查看答案和解析>>
科目: 來源: 題型:
【題目】(1)高溫下,C(s)+H2O(g)![]() CO(g)+H2(g) ΔH>0,反應的化學平衡常數表達式K=____ ,該反應隨溫度升高,K值___(填增大、減小或不變),該反應在高溫下自發進行的原因是_____。
CO(g)+H2(g) ΔH>0,反應的化學平衡常數表達式K=____ ,該反應隨溫度升高,K值___(填增大、減小或不變),該反應在高溫下自發進行的原因是_____。
(2)向重鉻酸鉀溶液中加入氫氧化鈉固體,溶液的顏色變化為____,原因是(請從平衡的角度用化學用語及必要的文字說明)____。
(3)密閉容器中充入N2O4達化學平衡,壓縮體積達新平衡,整個過程的現象為____。
(4)多元弱酸的逐級電離平衡常數為K1、K2、K3……,則K1、K2、K3的大小關系為___。
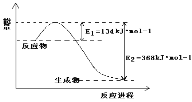
(5)1molNO2和1molCO反應生成CO2和NO過程中的能量變化如圖,請寫出NO2和CO反應的熱化學方程式___,向上述可逆反應中加入催化劑,則E1____(填增大、減小或不變,下同);此反應的ΔH____。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列各表述與示意圖一致的是( )
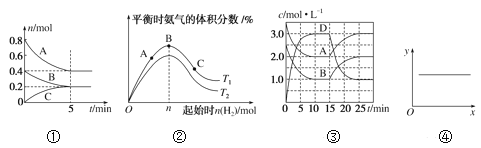
A. ①反應從開始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. ②N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,T1和T2表示溫度,則:T1>T2
2NH3(g) ΔH<0,T1和T2表示溫度,則:T1>T2
C. ③A(g)+B(g)![]() C(s)+2D(g) ΔH>0,反應至15min時,改變的條件是降低溫度
C(s)+2D(g) ΔH>0,反應至15min時,改變的條件是降低溫度
D. ④2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,當x表示溫度時,y表示平衡常數K
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,當x表示溫度時,y表示平衡常數K
查看答案和解析>>
科目: 來源: 題型:
【題目】下列各表述與示意圖一致的是
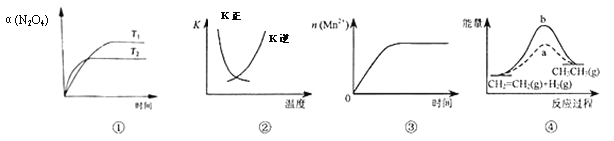
A. 圖①表示N2O4(g)![]() 2NO2(g) ΔH>0,N2O4轉化率隨溫度、時間的變化
2NO2(g) ΔH>0,N2O4轉化率隨溫度、時間的變化
B. 圖②中曲線表示反應2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,正、逆反應的平衡常數K隨溫度的變化
2SO3(g) ΔH<0,正、逆反應的平衡常數K隨溫度的變化
C. 圖③表示10 mL0.01 mol/LKMnO4酸性溶液與過量0.1mol/LH2C2O4溶液混合時,n(Mn2+)隨時間的變化
D. 圖④中a、b曲線分別表示反應CH2=CH2(g)+H2(g)![]() CH3CH3(g) ΔH<0,使用和未使用催化劑時,反應過程中的能量變化
CH3CH3(g) ΔH<0,使用和未使用催化劑時,反應過程中的能量變化
查看答案和解析>>
科目: 來源: 題型:
【題目】已知: M是人們日常生活中一種重要調料,也是一種重要的化工原料,在灼燒時,焰色反應呈黃色。A、B、D均為單質,在F的溶液中加入硫氰化鉀溶液,溶液變成血紅色,各物質的轉化關系如下圖所示:

根據以上信息回答下列問題:
(1)M和水發生電解的化學方程式____________。
(2)寫出E溶于水的電離方程式__________。
(3)F和D反應生成G的離子方程式為____________。
(4)向G的溶液中滴加C的溶液,觀察到的現象為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】t℃時,在體積不變的密閉容器中發生反應:X(g)+3Y(g)![]() 2Z(g),各組分在不同時刻的濃度如表,下列說法正確的是( )
2Z(g),各組分在不同時刻的濃度如表,下列說法正確的是( )
物質 | X | Y | Z |
初始濃度/mol/L | 0.1 | 0.2 | 0 |
2min末濃度/mol/L | 0.08 | a | b |
平衡濃度/mol/L | 0.05 | 0.05 | 0.1 |
A. 平衡時,X的轉化率為20% B. t℃時,該反應的平衡常數為40
C. 增大平衡后的體系壓強,v正增大,v逆減小,平衡向正反應方向移動 D. 前2min內,用Y的變化最表示的平均反應速率v(Y)=0.03mol/(L·min)
查看答案和解析>>
科目: 來源: 題型:
【題目】按要求完成下列填空。甲、乙、丙三種物質之間有如下圖所示的轉化關系,其中甲物質為氧化物:

(1)若甲是不溶于水的白色固體,是剛玉的主要成分,且既能溶于硫酸又能溶于氫氧化鈉溶液;乙的酸根中含有金屬元素。寫出下列物質間的轉化: 甲![]() 乙的離子方程式___;丙
乙的離子方程式___;丙![]() 甲的化學方程式____。
甲的化學方程式____。
(2)若甲是無色氣體,也是形成酸雨的物質;乙在標準狀況下為無色晶體。 寫出下列物質間的轉化:甲![]() 乙的化學反應方程式____________;丙
乙的化學反應方程式____________;丙![]() 甲的化學反應方程式_________。
甲的化學反應方程式_________。
查看答案和解析>>
科目: 來源: 題型:
【題目】根據如圖所示的反應判斷下列說法中錯誤的是

A. CO2(g)和CaO(s)的總能量大于CaCO3(s)的總能量
B. 該反應的焓變大于零
C. 該反應中有離子鍵斷裂也有共價鍵斷裂,化學鍵斷裂吸收能量,化學鍵生成放出能量
D. 由該反應可推出凡是需要加熱才發生的反應均為吸熱反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com